|
Buscador |
Estrategia de búsqueda:
|
|
|
Pubmed |
(MIS-C[MeSH Terms]) OR ((COVID-19[MeSH Terms]) AND (child[MeSH
Terms])) AND (treatment[MeSH Terms]) |
|
|
Scielo |
"multisystem
inflammatory syndrome" AND "treatment" |
|
|
Science
Direct |
"multisystem
inflammatory syndrome"
"treatment" |
|
|
Google
Scholar |
"MIS-C"
AND "treatment" |
|
|
Cochrane |
Palabra clave: multisystem inflammatory syndrome |
|
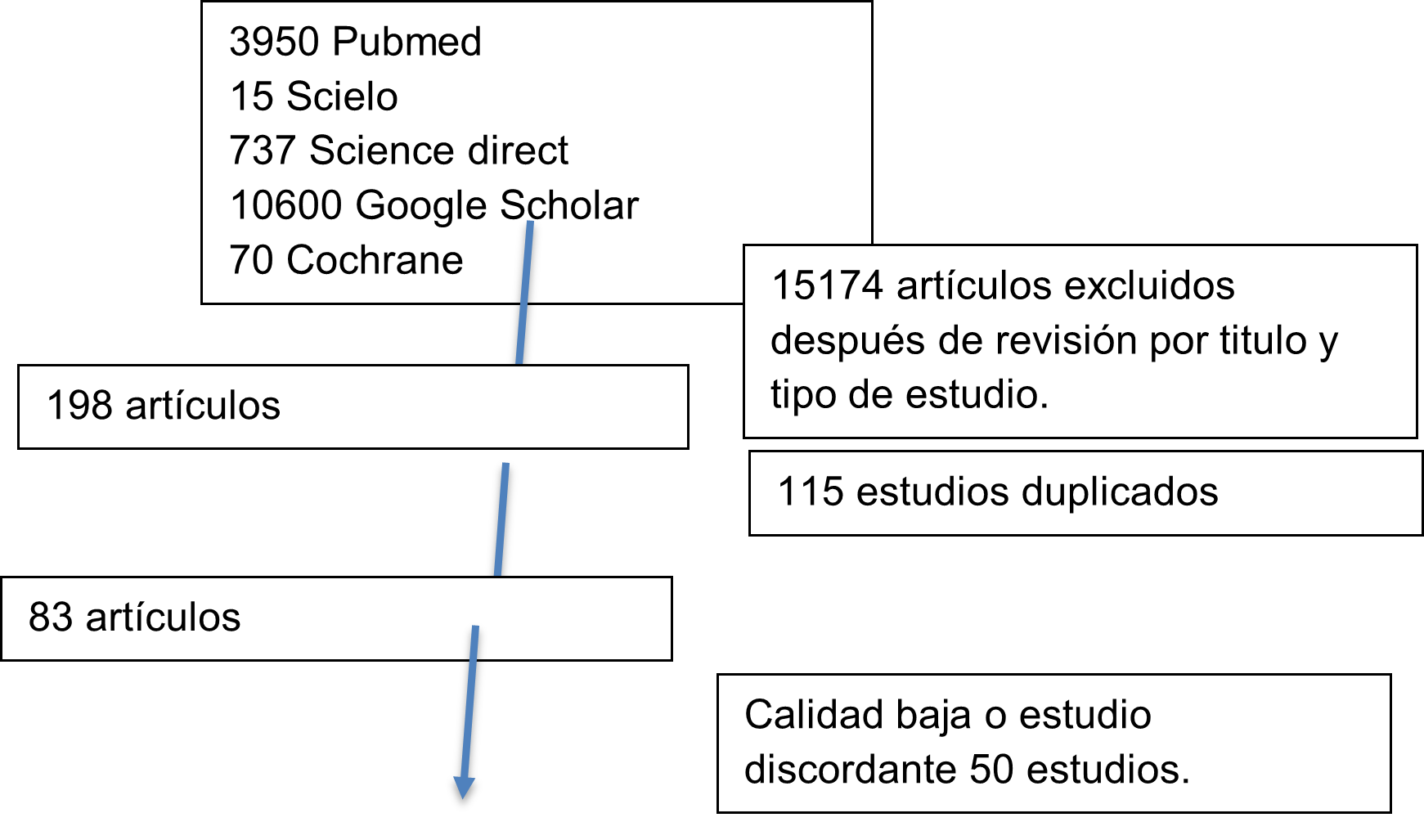
Para la selección, dos de los autores se encargaron de la selección de artículos y en caso de ambigüedad o duda se solicitó ayuda al tercer autor. De la estrategia de búsqueda se encontraron: 3950 en Pubmed, 15 en Scielo, 737 en Science Direct , 90 en Google Scholar y 68 en Cochrane.
Resultados
Diagrama de flujo de prisma. 33 artículos.
Tratamiento de soporte
El tratamiento de cuidados intensivos de estos pacientes está justificado en los informes más recientes. La hipotensión en niños con MIS-C a menudo es resistente a la fluidoterapia intravenosa, por lo que se deben usar inotrópicos y / o vasopresores de manera apropiada en tales casos. Se recomienda la epinefrina como primera opción en los niños y se debe usar norepinefrina si el shock persiste14. Se recomienda el uso de dobutamina o dopamina en pacientes con disfunción miocárdica debido a su efecto inotrópico14. En los niños que presentan shock (la mayoría ha informado de un shock vasodilatador), la reanimación con líquidos es imperativa en el tratamiento inicial14. Dado que existe un alto potencial de disfunción cardíaca subyacente, los pacientes deben ser reevaluados con frecuencia durante la reanimación con líquidos para detectar evidencia de sobrecarga de líquidos, como edema pulmonar o hepatomegalia14. En los centros con ecografía de cabecera disponible, se puede considerar la evaluación de la función cardíaca al comienzo de la reanimación para determinar el mejor tratamiento14.
Dentro del tratamiento de soporte, se encuentra el uso de la terapia complementaria por parte de los dispositivos de oxigenación por membrana extracorpórea (ECMO), uso de una bomba de balón intraaórtica, plasmaféresis o las terapias de soporte vital en el caso de la ventilación mecánica15.
Inmunoglobulina y corticoides
En general, se recomiendan dosis altas de Ig IV inespecífica (1-2 g / kg) para el tratamiento de MIS-C. Los pacientes en categorías de alto riesgo (lactantes, síndrome de choque, PCR> 130 g / dL, puntuación Z del eco al ingreso> 2,5 o aneurismas, raza asiática) deben recibir Ig IV 2 g / kg como infusión única; si la presentación es más consistente y el tratamiento de primera línea falla, se podría considerar una segunda dosis de IgIV13. En primer lugar, IVIG implica la infusión de grandes volúmenes (40 ml / kg) que puede causar sobrecarga cardíaca, especialmente en pacientes con disfunción miocárdica; además, la IVIG aumenta la presión oncótica y en consecuencia, provoca un desplazamiento de líquido, que puede empeorar aún más la sobrecarga de líquidos en estos pacientes, que a menudo presentan hipoalbuminemia y tercer espacio; es por ello que se han desarrollado protocolos de preservación para evitar la infusión de IVIG en la fase temprana de la enfermedad, cuando el riesgo de insuficiencia cardíaca es alto. Los niños que presentan síntomas de EK deben ser reevaluados 24 a 36 h después del final de la infusión de IgIV en busca de signos de fiebre o inflamación en curso. Si la inflamación clínica continúa o empeora, se debe considerar un retratamiento o una nueva terapia. Se pueden considerar las dosis altas de corticosteroides (terapia de pulsos de metilprednisolona) para el tratamiento de pacientes refractarios o pacientes con complicaciones potencialmente mortales como el shock16.
Tratamiento anticoagulante
La aspirina (para antiinflamatorios o profilaxis de la trombosis) y / o anticoagulantes se administran comúnmente a niños con MIS-C. Se recomienda aspirina en dosis bajas (3-5 mg / kg por medicación oral una vez al día) en pacientes con MIS-C con características similares a enfermedad de Kawasaki, aneurisma coronario o trombocitosis17. Se recomienda aspirina 20-25 mg / kg / dosis cada 6 h (80-100 mg / kg / día) para todos los pacientes con enfermedad similar a KD, evidencia de inflamación excesiva (ferritina> 700 ng / mL, PCR> 30 g / dL o falla orgánica multisistémica) o compromiso cardíaco. La dosis de aspirina también puede variar en los centros individuales17.
Las estrategias con respecto a la anticoagulación profiláctica en pacientes pediátricos con COVID-19 varían institucionalmente, pero muchos han optado por una estrategia de anticoagulación profiláctica mínima en adolescentes y en pacientes críticos. Es razonable considerar la anticoagulación profiláctica con enoxaparina en pacientes críticamente enfermos y pacientes hospitalizados con alteraciones importantes de la coagulación. Los pacientes con aneurismas de las arterias coronarias grandes o en expansión requerirán anticoagulación terapéutica y terapia antiplaquetaria16. Se recomienda la terapia de anticoagulación con heparina, enoxaparina o warfarina para los pacientes con MIS-C con un aneurisma coronario gigante (diámetro> 8 mm) o una puntuación z de la arteria coronaria> 10. MIS-C18.
Agentes biológicos
Entre los medicamentos biológicos usados para el MIS-C se encuentra la An akinra, la cual se ha sido usada en algunos estudios como el de Fouriki A, et al realizado en Suiza en el 2021; en este estudio se realiza un seguimiento a 6 niños con MIS-C, SARS-CoV2 y Kawasaki, se evidencia la eficacia de este agente biológico con evolución favorable en 4 de los 6 pacientes, donde uno de ellos lo usó en monoterapia, el estudio sugiere el uso de Anakinra como alternativa a los esteroides en estos niños, la mayoría de los cuales presentaba niveles elevados de IL-1RA19.
Algunos pacientes refractarios al uso de inmunoglobulina pueden recibir anticuerpos monoclonales contra el receptor de IL-6 (tocilizumab), antagonista del receptor de IL-1 (anakinra), anticuerpos monoclonales contra el factor de necrosis tumoral (infliximab) o terapia con plasma de convalecencia14. Anakinra tiene una vida media corta y un inicio de acción rápido, lo que permite una interrupción rápida del tratamiento en casos de reacciones adversas. Anakinra (> 4 mg / kg / día IV o inyección subcutánea) se recomienda para pacientes cuyo MIS-C es refractario a IVIG y / o tratamiento con corticosteroides20. Se debe controlar la función hepática de los niños que han recibido anakinra. Tocilizumab (<30 kg: 12 mg / kg IV; ≥30 kg: 8 mg / kg IV; máx .: 800 mg) puede reducir eficazmente la mortalidad y la necesidad de ingreso en la unidad de cuidados intensivos en pacientes con neumonía grave, sin embargo, los pacientes tratados con tocilizumab pueden tener un mayor riesgo de desarrollar infecciones bacterianas o micóticas. No hay consenso sobre cuál de estos agentes es óptimo y la elección del fármaco puede depender de la preferencia del médico, los resultados de las pruebas de citocinas y la disponibilidad del fármaco20.
Otros tratamientos
Los antibióticos no se encuentran recomendados por ser consecuencia de un patógeno viral, por tanto, si no existe evidencia de sobreinfección y los cultivos se encuentran negativos luego de 48 horas, se sugiere la suspensión antibiótica. El único agente viral comprobado contra la actividad del SARS-CoV-2 es el Remdesivir, demostrado en algunos ensayos clínicos, sin un respaldo suficiente de información21. La dosis propuesta es de 5 mg / kg de carga IV una vez (dosis máxima de 200 mg) el día 1, luego 2,5 mg / kg (dosis máxima de 100 mg) IV al día durante nueve días21.
Evidencia del tratamiento del síndrome inflamatorio multisistémico (MIS - C) pediátrico asociado a SARS- COV-2
|
Ficha bibliográfica |
Población |
Tipo de estudio |
Tratamiento |
Efecto |
Nivel de evidencia (según Sackett) |
Resumen |
|
Santos, MO et al. 202222 |
98 estudios. 58% varones con edad media de 8,9 años. |
Revisión sistemática |
Soporte: Antibioticos en los primeros dias luego se suspendieron
Tratamiento: · 84% IGIV · 78% antiplaquetario o anticoagulante · 64% corticoides · 16% antivirales · 27% inmunomodulador biológico Terapia: 50% soporte respiratorio 6% ECMO
|
Solo 2% de pacientes fallecieron |
IA |
Se revisaron bases de datos: WOS, Scielo, Pubmed, EBSCO, EMBASE, Scopus y Science direct. Se realizó metaanálisis por análisis de subgrupos según heterogeneidad. |
|
Pouletty M, et al (Francia), 202023 |
16 pacientes, 8 hombres, edad media 10 años |
Cohorte |
16 recibieron IG IV, de los cuales: 5 recibieron una segunda infusión ( 1 de ellos con uso de corticoides) 2 recibieron corticoide 2 recibieron biológicos |
06 de los 15 pacientes que recibieron IGIV fueron exitosos. 10 requirieron una segunda línea de tratamiento y 1 falleció.
|
2b |
Seguimiento de tratamiento con dos líneas: en la primera línea infusion de inmunoglobulina endovenosa, en la segunda línea uso de IGIV + corticoide, corticoide solo y agente biológico solo. (antagonista de IL-1 e IL-6) |
|
Mc Ardle A, et al (Reino Unido, 2021)24
|
614 pacientes con media de edad de 7 a 13 años. |
Cohorte |
IGIV + corticoide: 246 Corticoide solo: 99 IGIV sola: 246. |
Ingresaron a tratamiento soporte y/o murieron en los 2 primeros días: IGIV + corticoide: 56 pacientes Corticoide solo: 17 pacientes Redujeron gravedad: IGIV+ corticoide: 54 Corticoide solo: 20 |
2b |
Tres grupos: 1. Uso de IGIV 2. Uso de IGIV + corticoide 3. Uso de corticoide. |
|
Abdel N, et al (Turquia, 2021)
|
33 niños con una edad entre 1,3 a 10 años. |
Transversal comparativo |
Primera línea de tratamiento: IGIV Segunda línea de tratamiento: IGIV Infliximab Corticoides. |
9 de 22 pacientes con enfermedad crítica respondieron a terapia de primera línea con IGIV 12 pacientes mejoraron a la segunda línea de tratamiento con uso de infliximab 1 paciente mejora con una segunda infusion de IGIV
|
4C |
Se comparan dos grupos : grupo 1 con enfermedad crítica (22 pacientes) y grupo 2 sin enfermedad crítica (11 pacientes), se realiza evaluación de su tratamiento y resultados. |
Discusión
En cuanto al manejo, existe una brecha, los estudios europeos señalan un tratamiento dirigido con el uso de inmunoglobulina, corticoides, interleucina, e incluso la terapia biológica en ciertos casos de severidad; mientras que para Perú, el tratamiento es un poco restringido debido a la dificultad en los recursos obtenidos a nivel nacional, donde la inmunoglobulina se encuentra disponible bajo vigilancia farmacológica y no se encuentran disponibles tratamientos biológicos en la mayoría de hospitales a nivel nacional, por lo que se opta por un manejo de soporte aunado al uso de corticoides y en ciertos casos, la inmunoglobulina. 23,32,33.
Ouldali en su revisión del 2021 señala que el manejo depende mucho de la experiencia del médico que tiene a cargo al paciente y por ser un sindrome hiperinflamatorio, se usan fármacos como los anteriormente mencionados; la diferencia del manejo entre el caso peruano y a nivel internacional difiere no sólo por los recursos sino tambien por la ausencia de una guía de manejo en la práctica clínica a nivel nacional; se evidencia en el estudio del 2021 que de los 18 casos descritos de MIS-C asociado a COVID 19, el manejo se sostuvo principalmente con inmunoglobulina, donde en ciertas ocasiones, tuvieron un segundo ciclo de esta terapia, mientras que no se encuentran descritos los pulsos de corticoides como una terapia habitual, sin embargo, Licciardi F et al evaluó un protocolo de tratamiento en Italia en 2021, donde se realizaron pulsos de corticoides, específicamente de metilprednisolona con dosis entre 2 a 10 mg/kg y se encontró que solo el 3,2% de 31 pacientes requirieron la entrada a una unidad de cuidados intensivos25.27.
La importancia de un manejo protocolizado es esencial y así lo enmarca Elias D et al, en su estudio realizado en Canadá en el año 2020, este autor evaluó los enfoques del manejo de la enfermedad en 38 instituciones de 11 países, si bien, se usó el tratamiento inmunomodulador en el 58% de los casos, sólo se se usaban los corticoides para los casos de presentación clínica grave o ausencia de respuesta al tratamiento con inmunoglobulina, mientras que para Perú, ante la refractariedad al tratamiento se opta por un segundo ciclo de Ig 32, 33.
El fracaso al tratamiento en el contexto de este síndrome es muy común, y se asocia sobre todo con el tratamiento bajo inmunoglobulina IV, igualmente, el uso de corticoides usado en la refractariedad al tratamiento, llevó a la disminución de la curva febril entre los pacientes tan solo al siguiente día de haberse iniciado el tratamiento según el estudio de cohorte de Vukomanovic R et al realizado en Serbia en el 2021, en este estudio, los autores comparan la eficacia entre el manejo con Ig y el uso de corticoides, evidenciando que son los corticoides los que inducen a una mayor disminución de los marcadores inflamatorias y del PCR a comparación del uso de corticoterapia entre otros efectos, se encontró una mejora en la fracción de eyección y en la disminución de la estancia en unidad crítica para el paciente con un valor medio de 4 días para el grupo de corticoides y de 7 para el grupo de inmunoglobulina considerando un p significativo de 0.00228.
Si bien a nivel nacional, la afectación cardiovascular no es tan frecuente como la respiratoria y abdominal, la evidencia nos señala que estos pacientes llegar a evolucionar favorablemente bajo el tratamiento de inmunoglobulina, así lo resalta Belhadjer J, et al en Arabia, 2020, el mismo que reporta la evolución de la función cardíaca en niños ingresados por MIS-C, definida por fiebre persistente (> 38.5 ° C) por> 3 días, afectación multiorgánica, evidencia de coagulopatía (dímeros D> 1000 ng / mL), inflamación (proteína C reactiva> 80 mg / L) y ensayos de anticuerpos positivos para la infección por SARS-CoV-2; la mediana de edad fue de 8,6 años (rango intercuartílico [RIQ], 6,7-11,2). En este estudio, dieciocho pacientes recibieron IgIV (2 g / kg una vez) como tratamiento de primera línea, y los 22 pacientes ingresados después de esta fecha recibieron una combinación de IgIV y metilprednisolona intravenosa (0,8 mg · kg – 1 · d – 1 durante 5 días). El hallazgo principal fue la reducción del tiempo de recuperación de la FEVI y la TRIV, y la permanencia en la unidad de cuidados intensivos pediátricos en el grupo que recibió una combinación de IgIV y esteroides en comparación con el grupo que recibió solo IgIV, respectivamente, 2,9 frente a 5,4 días, 6,4 frente a 20,6 días y 3,4 frente a 5,3 días (P <0,05)29, 32,33.
Los estudios peruanos resaltan el hecho de una frecuente admisión de la población con este síndrome dentro de las unidades críticas, sin embargo, no todas llegan a ventilación mecánica, lo que resalta el hecho de que la admisión se crea por precaución más que por necesidad debido a la gravedad del paciente, lo cual es un punto de controversia dentro de la disponibilidad de estas camas en el ambiente hospitalario. Abdel N, et al en su estudio realizado en Turquía en el año 2021, evaluó las características de los niños ingresados a una unidad de cuidados intensivos y los que no requirieron de la misma, encontrando que los que presentaron una enfermedad más severa (grupo 1) tenían una media de edad de 7 años mientras que los del grupo 2 tenían una media de 2 años; por otro lado, se encontró que la inmunoglobulina se usaba indistintamente en cualquiera de los dos grupos, siendo más frecuente en el primero. En este estudio se puede evidenciar que no existe una regla de inicio para el tratamiento con inmunoglobulina, mientras que a nivel de Perú, la inmunoglobulina se usa solo en casos de severidad mayor de la enfermedad. 30,32,33.
En la revisión sistemática y metaanálisis de Kaushik A, et al (India, 2020); realizado en base de estudios de corte transversal, de cohortes, series de casos e informes de casos; se encontraron dieciséis estudios con 655 participantes (de 3 meses a 20 años de edad);aquí se pudo evidenciar que los signos y síntomas de la enfermedad son frecuentes sobre todo ante un grado de severidad mayor de la enfermedad e incluso, puede llegar a coexistir la enfermedad de Kawasaki, asimismo, las terapias usadas son generalmente para el manejo de las complicaciones como la necesidad de inotrópicos en el 40% de los casos o el cuidado en unidad crítica en el 68% de los casos, donde se evidencia que la necesidad de ventilación mecánica no es muy común dentro del síndrome con un 15% de afectación de la población enferma.31
La mayoría de los artículos incluidos en esta revisión señala que la inmunoglobulina endovenosa es uno de las terapias esenciales en el manejo de la enfermedad, y que la corticoterapia suele ser usarse para potenciación de efecto o en caso de refractariedad al uso de IGIV, lo que concuerda con la revisión sistemática de Kaushik que señala que más de dos tercios de los pacientes recibieron inmunoglobulina intravenosa, y el 49% recibió corticosteroide, mientas que los tratamientos con Remdesivir y plasma convaleciente fueron las terapias menos utilizadas; ello quizá por la falta de evidencia en estudios de seguimiento.31.
Limitaciones
Esta revisión no incluyó ensayos clínicos, ni series de casos que pueden proveer información importante actualizada sobre el tratamiento experimental del síndrome.
Conclusiones
Se concluye que en la actualidad, el tratamiento de primera línea lo constituye el uso de inmunoglobulina intravenosa (IGIV) en dosis elevadas, donde el uso de corticoides puede encontrarse de forma combinada, potenciando las tasas de éxito a comparación del uso de corticoides solo,mientras que el tratamiento de segunda línea corresponde al uso de inmunomoduladores como antagonistas de IL-6 (tocilizumab), antagonista de IL-1 (anakinra) yantagonista del factor de necrosis tumoral (infliximab) que generalmente se presenta como terapia de rescate ante resistencia del uso de inmunoglobulina, con tasas de éxito altas. Por otro lado, el tratamiento con uso de ácido acetilsalicílico y de agentes anticoagulantes se indica en los casos de complicaciones cardiovasculares.
Financiación: Ninguna
Conflicto de intereses
No hay ningún conflicto de intereses conocido.
Referencias
1. Qiu H., Wu J., Hong L. Clinical and epidemiological features of 36 children with coronavirus disease 2019 (COVID-19) in Zhejiang, China: an observational cohort study. Lancet Infect Dis. 2020; 5(2):14-18.
2. La Torre F, Taddio A, Conti C, Cattalini M. Multi-Inflammatory Syndrome in Children (MIS-C) in 2023: Is It Time to Forget about It? Children (Basel). 2023 May 31;10(6):980. doi: 10.3390/children10060980. PMID: 37371212; PMCID: PMC10297102. Montaño-Luna VE, Miranda-Novales MG. Actualización del manejo clínico de COVID-19 en pediatría: a un año de pandemia. Rev Mex Pediatría [Internet]. 7 de mayo de 2021 [citado 7 de diciembre de 2023];88(1):31-45. Disponible en: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=99417 .
3. Kim H, Shim JY, Ko JH, Yang A, Shim JW, Kim DS, et al. Multisystem inflammatory syndrome in children related to COVID-19: the first case in Korea. J Korean Med Sci 2020;35:e391-8.
4. Jain S, Sen S, Lakshmivenkateshiah S, Bobhate P, Venkatesh S, Udani S, et al. Multisystem inflammatory syndrome in children with COVID-19 in Mumbai, India. Indian Pediatr 2020;57:e1015-9.
5. Mamishi S, Movahedi Z, Mohammadi M, Ziaee V, Khodabandeh M, Abdolsalehi MR, et al. Multisystem inflammatory syndrome associated with SARS-CoV-2 infection in 45 children: a first report from Iran. Epidemiol Infect 2020;148:e196.
6. Moraleda C, Serna-Pascual M, Soriano-Arandes A, Simo S, Epalza C, Santos M, et al. Multi-inflammatory syndrome in children related to SARS-CoV-2 in Spain. Clin Infect Dis 2020;ciaa1042.
7. Molloy EJ, Nakra N, Gale C, Dimitriades VR, Lakshminrusimha S. Multisystem inflammatory syndrome in children (MIS-C) and neonates (MIS-N) associated with COVID-19: optimizing definition and management. Pediatr Res [Internet]. mayo de 2023 [citado 7 de diciembre de 2023];93(6):1499-508. Disponible en: https://www.nature.com/articles/s41390-022-02263-w
8. Antunez O. COVID-19 and multisystem inflammatory syndrome in Latin American children: a multinational study. Pediatr Infect Dis J 2021;40:e1-6.
9. Rowley AH. Understanding SARS-CoV-2-related multisystem inflammatory syndrome in children. Nat Rev Immunol 2020;20:453-4.
10. Verdoni L., Mazza A., Gervasoni A. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet. 2020; 6(2):14-16.
11. Riphagen S., Gomez X., Gonzalez-Martinez C., Wilkinson N., Theocharis P. Hyperinflammatory shock in children during COVID-19 pandemic. Lancet. 2020; 6: (20)31094-1.
12. Londoño-Martinez J. Consenso colombiano de atención, diagnóstico y manejo de la infeccioón por SARS-Cov-2/COVID 19 en establecimientos de atención de la salud [Internet]. Revista de la asociación colombiana de infectología.; 2021 [citado 6 de diciembre de 2023]. Disponible en:
https://www.acin.org/index.php/publicaciones/consenso-colombiano-de-atencion
13. Gottlieb M, Bridwell R, Ravera J, Long B. Multisystem inflammatory syndrome in children with COVID-19. Am J Emerg Med. 2021 Nov;49:148-152.
14. Hee J. Clinical features, diagnosis, and outcomes of multisystem inflammatory syndrome in children associated with coronavirus disease Clin Exp Pediatr 2019; 64 (2): 68–75.
15. Kwak, J. H., Lee, S. Y., Choi, J. W., & Korean Society of Kawasaki Disease (2021). Clinical features, diagnosis, and outcomes of multisystem inflammatory syndrome in children associated with coronavirus disease 2019. Clinical and experimental pediatrics, 64(2), 68–75.
16. Hennon T. COVID-19 associated Multisystem Inflammatory Syndrome in Children (MIS-C) guidelines; a Western New York approach. Prog Pediatr Cardiol. 2020; 23 : 101232.
17. Henderson LA, Canna SW, Friedman KG, Gorelik M, Lapidus SK, Bassiri H, et al. American college of rheumatology clinical guidance for multisystem inflammatory syndrome in children associated with SARS-CoV-2 and hyperinflammation in pediatric COVID-19: version 1. Arthritis Rheumatol. (2020) 72:1791–805.
18. Cron R.Q., Chatham W.W. The rheumatologist’s role in COVID-19. J Rheumatol. 2020;47(5):639–642.
19. Fouriki A, Fougère Y, De Camaret C, Blanchard Rohner G, Grazioli S, Wagner N, Relly C, Pachlopnik Schmid J, Trück J, Kottanatu L, Perez E, Perez M-H, Schaffner D, Asner SA and Hofer M. Case Report: Case Series of Children With Multisystem Inflammatory Syndrome Following SARS-CoV-2 Infection in Switzerland. Front. Pediatr 2021; 8:594127.
20. Pouletty M. Paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2 mimicking Kawasaki disease (Kawa-COVID-19): a multicentre cohort. Ann Rheum Dis 2020;79:999–1006.
20. Klok F. Confirmation of the high cumulative incidence of thrombotic complications in critically ill ICU patients with COVID-19: an updated analysis. Thromb Res. 2020 Apr 30 doi: 10.1016/j.thromres.2020.04.041.
21. Ye Q. The pathogenesis and treatment of the ‘Cytokine Storm’ in COVID-19. J Infect. 2020;80(6):607–613.
22. Santos, M. O., Gonçalves, L. C., Silva, P. A. N., Moreira, A. L. E., Ito, C. R. M., Peixoto, F. A. O., Multisystem inflammatory syndrome (MIS-C): a systematic review and meta-analysis of clinical characteristics, treatment, and outcomes. Jornal de pediatria, 2022; 98(4): , 338–349.
23. Pouletty M. Paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2 mimicking Kawasaki disease (Kawa-COVID-19): a multicentre cohort. Ann Rheum Dis 2020;79:999–1006. .
24.- Mc Ardle A. Treatment of Multisystem Inflammatory Syndrome in Children. N Engl J Med 2021; 385:11-22.
25. Ouldali N. Association of Intravenous Immunoglobulins Plus Methylprednisolone vs Immunoglobulins Alone With Course of Fever in Multisystem Inflammatory Syndrome in Children. JAMA. 2021;325(9):855-864.
26.- Haneen K. COVID-19 in children: an approach for multisystem infammatory syndrome. Egypt Pediatric Association Gaz 2021; 69:33. .
27.- Licciardi F, Baldini L, Dellepiane M, Covizzi C, Mogni R, Pruccoli G, Orsi C, Rabbone I, Parodi E, Mignone F and Montin D. MIS-C Treatment: Is IVIG Always Necessary? Front. Pediatr. 2021; 9:753123.
28.- Vukomanovic R. Recent Experience: Corticosteroids as a First-line Therapy in Children With Multisystem Inflammatory Syndrome and COVID-19-related Myocardial Damage. Pediatr Infect Dis J 2021;40(11):e390-e394.
29.- Belhadjer J. Addition of Corticosteroids to Immunoglobulins Is Associated With Recovery of Cardiac Function in Multi-Inflammatory Syndrome in Children. Circulation 2020; 142 (23): 2282-2284.
30.- Abdel N. SARS-CoV-2-associated multisystem inflammatory syndrome in children: clinical manifestations and the role of infliximab treatment. Eur J Pediatr. 2021; 16 : 1–11.
31. Kaushik A. A Systematic Review of Multisystem Inflammatory Syndrome in Children Associated With SARS-CoV-2 Infection. Pediatr Infect Dis J 2020;39:e340–e346.
32. Cieza-Yamunaqué, L., Rodríguez-Portilla, R., Baique-Sánchez, M. Evolution and management of the pediatric multi-systemic inflammatory syndrome associated with SARS CoV-2 infection in a pediatric ICU in Lima, Peru. Rev. Cuerpo Med. HNAAA, Vol 14 (3) – 2021, 262 – 266.
33. Liz E. De Coll-Vela, Mariela K. Zamudio-Aquise, Héctor Nuñez-Paucar. Covid-19–associated multisystem inflammatory syndrome in children: case series at a pediatric hospital in Perú. Rev Peru Med Exp Salud Publica. 2020;37(3):559-65.
