Pediatría
ISSN impreso:0120-4912
e-ISSN:2444-9369
DOI: 10.14295/rp.v55i3.353
Revisión
Tiña capitis en Niños: Pandemia aún no erradicada
Tinea capitis in Children: A pandemic not yet eradicated
Sebastián Gómez Restrepoa, Jairo Victoria Chaparrob.
a. Residente de Dermatología Universidad Libre Seccional Cali, Colombia.
b. Dermatólogo Pediátrico, Epidemiólogo, Coordinador Especialización en Dermatología Universidad Libre Seccional Cali, Colombia.
Recibido 2 de febrero de 2022 Aceptado 26 de agosto de 2022
Como Citar: Gómez Restrepo S, Victoria Chaparro J. Tiña capitis en Niños: Pandemia aún no erradicada. Pediatr. 2022;55(3:)142-149.
Autor para correspondencia: Sebastián Gómez Restrepo
Correo electrónico: sebas.r.s@hotmail.com
Editor adjunto: Alvaro León Jácome Orozco
Resumen
Antecedentes: la Tiña de la Cabeza o Tiña Capitis es una enfermedad propia y casi exclusiva de la infancia causada por alguna de las especies de dermatofitos usualmente de los géneros Microsporum y Trichophyton. Temática: entre los factores de riesgo asociados a la primoinfección está el uso de equipos de peluquería contaminados con los microorganismos, el contacto con animales o bien, directamente de persona a persona. El dato clínico más relevante es la aparición de una o varias placas alopécicas o pseudoalopécicas con pelos cortos y rotos, eritema, descamación y ocasionalmente la presencia de pápulas y pústulas. Metodos: revisión narrativa. Se identificaron artículos de las bases de datos ScienceDirect, Scopus, PubMed, MEDLINE y Google Scholar, publicados entre 1982 y 2021 que tuvieran en el título los términos, tiña capitis, dermatomicosis en niños, antifúngicos en niños, niños, diagnóstico de Tinea capitis, epidemiología y dermatomicosis, utilizando los conectores «AND» y «OR». Esta revisión se llevó a cabo durante un período de seis meses desde agosto de 2021 hasta enero de 2022. Resultados: la evolución de la infección puede afectar la calidad de vida de los pacientes, por lo que se vuelve imprescindible la confirmación microbiológica que permita un tratamiento adecuado. Conclusión: el manejo debe ser con medicamentos vía oral por lo menos durante cuatro semanas y entre los fármacos utilizados se encuentra la griseofulvina, terbinafina e itraconazol.
Palabras clave: Tiña, Dermatomicosis, cultivo, antifúngico.
Abstract
Background: Tinea Capitis or Tinea Capitis is an almost exclusive childhood disease caused by one of the dermatophyte species, usually of the Microsporum and Trichophyton genera. Topic: among the risk factors associated with primary infection is using hairdressing equipment contaminated with microorganisms, contact with animals, or directly from person to person. The most relevant clinical data is the appearance of one or several alopecic plaques or pseudo alopecia with short and broken hairs, erythema, scaling, and occasionally the presence of papules and pustules. Methods: a narrative review. The identified articles came from the ScienceDirect, Scopus, PubMed, Medline, and Google Scholar databases, published between 1982 and 2021, with the following terms in the paper title: Tinea capitis, dermatomycosis in children, antifungals in children, children, diagnosis of Tinea capitis, epidemiology dermatomycosis. The words were related with connectors «AND», «OR». This review was carried out over six months, from August 2021 to January 2022. Results: the evolution of the infection can affect patients' quality of life, so microbiological confirmation is essential to allow proper treatment. Conclusion: management should be with oral medications for at least four weeks. Among the drugs used are griseofulvin, terbinafine, and itraconazole.
Key words: Tinea, Dermatomycosis, culture, antifungal
Introducción
Las dermatofitosis son micosis superficiales producidas por hongos queratinófilos llamados dermatofitos que afectan la capa córnea de la piel y sus anexos (pelos y uñas). Entre ellas está la Tiña capitis (o tiña de la cabeza), en un estudio retrospectivo realizado en Colombia por Zuluaga y colaboradores se encontró una incidencia del 32 %, de 415 pacientes con sospecha clínica de Tiña capitis se confirmaron 133 casos con estudios de laboratorio, la mayoría de ellos fueron menores de edad, 131/133 (98 %) con una edad promedio de 5.4 años.
En el mismo estudió se halló que el agente etiológico más frecuentemente aislado fue el Microsporum canis (86 %), seguido con una amplia diferencia por el Microsporum gypseum (4 %), el Trichophyton tonsurans (3%), el Trichophyton mentagrophytes (3 %) y el Microsporum audouinii (3 %) (1).
El espectro clínico de la enfermedad va desde escamas pequeñas con poca pérdida de cabello hasta grandes placas inflamatorias con pústulas y alopecia extensa (2-3). Es altamente probable que el personal de salud se vea enfrentado en algún momento a infantes con esta infección durante la práctica clínica diaria, por lo que conocerla, diagnosticarla y tratarla resulta ser útil y oportuno pues se logra también evitar la propagación en grupos poblacionales de riesgo.
Métodos
Para la realización de este artículo de revisión se identificaron artículos de las bases de datos de ScienceDirect, Scopus, PubMed, MEDLINE y Google Scholar, publicados desde 1982 hasta 2021 que tuvieran en el título los términos: Tiña capitis, dermatomicosis en niños, antifúngicos en niños, diagnóstico de Tiña capitis, epidemiología y dermatomicosis. Los términos se relacionaron con los conectores «AND» y «OR» Esta revisión se realizó en un periodo de 6 meses desde el mes de agosto de 2021 hasta enero de 2022.
Epidemiología
Esta entidad representa un problema creciente de salud pública debido a cambios en los patrones geográficos y migratorios, se considera una de las infecciones cutáneas más comunes en niños prepúberes, la incidencia de infección es alta a nivel mundial y según la Organización Mundial de la Salud (OMS) es la segunda infección dermatológica infantil más común después de las causadas por estafilococos y estreptococos. (4). En los Estados Unidos, entre 1995 y 2004, las tasas de prevalencia de Tiña capitis fueron de hasta un 15 % oscilando entre 0 % y 19.4 % (5).
La infección se asocia con mala higiene y estatus socioeconómico bajo, aunque no siempre es así, además, se agregan otros factores como el reconocimiento tardío de lesiones sospechosas, período de incubación de varias semanas en las que los pacientes son contagiosos pero asintomáticos y la transmisión por animales domésticos (6).
El compromiso por Tiña Capitis se observa con mayor frecuencia en niños entre tres y siete años, los bebés y los adultos rara vez se ven afectados; los informes de compromiso en lactantes suelen estar relacionados a inmunosupresión y al uso de antibióticos de amplio espectro. No hay predilección por género, pero se ha evidenciado que la prevalencia es mayor en los niños, aunque algunos reportes informan mayor prevalencia en niñas afroamericanas; El cabello corto está asociado con una mayor incidencia porque las esporas de los hongos pueden acceder al cuero cabelludo más fácilmente (7).
Zaraá y col demostraron que existe un mayor riesgo de desarrollar tiña inflamatoria en poblaciones rurales con respecto a las poblaciones suburbanas, quizá debido a un mayor contacto con animales (8). Hay otros grupos poblacionales que tienen mayor riesgo de desarrollar Tiña capitis entre los que se incluyen pacientes con diabetes y anemia, inmunosuprimidos por leucemia, trasplante de órganos y por uso de inmunosupresores (9).
En adultos, los cambios hormonales importantes, incluso durante el embarazo y la menopausia pueden favorecer la propensión a infección secundaria a reducción de secreción de sebo con disminución de ácidos grasos y su acción fungistática y el subsiguiente aumento del pH del cuero cabelludo, facilitando así la colonización micótica (10).
Etiología
Los agentes etiológicos se clasifican en tres géneros anamórficos: Trichophyton, microsporum y Epidermophyton. Basado en el huésped usual y hábitat natural han sido agrupados en tres categorías: antropofílico, geofílico y zoofílico. (11) Las especies Antropofílicas suelen infectar a los seres humanos y los animales rara vez se ven afectados. Las geofílicas habitan el suelo e infectan tanto a los seres humanos como a los animales y las especies Zoofílicas son patógenos de animales, pero la trasmisión de animales a humanos puede ocurrir y a menudo producen una respuesta inflamatoria más severa (11).
Manifestaciones Clínicas
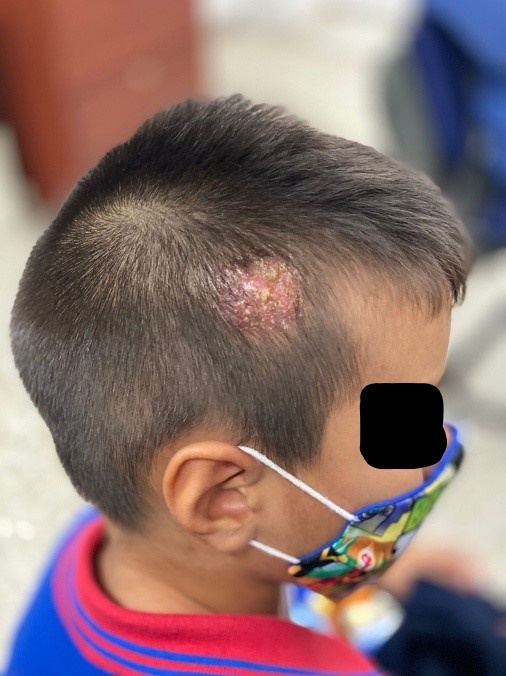
La Tiña capitis se puede dividir en: 1) Microspórica, causada por dermatofitos zoofílicos o geofílicos, se caracteriza por la presencia de una lesión única de gran tamaño con abundantes pelos cortos que dan la impresión de haber sido cortados al mismo nivel. (Ver figura 1). 2) Tricofítica, causada generalmente por agentes antropofílicos. La clínica incluye múltiples placas descamativas no eritematosas, de color blanco-grisáceo, ubicadas de forma difusa en el cuero cabelludo, los pelos sanos se mezclan con pelos enfermos, que se cortan al margen de su emergencia y se observan como puntos negros (12).
Dentro de la Tiña tricofítica se encuentra la Tiña fávica, una afección rara en las américas, pero relativamente frecuente en Europa. Se distingue por formar una masa seca, friable, amarillenta y maloliente. El agente etiológico que ocasiona este cuadro es Trichophyton schoenleinii (13-14).
Las especies de dermatofitos varían por país, así, en el Reino Unido, Estados Unidos, Jamaica y Brasil, se ha demostrado que Trichophyton tonsurans es el agente etiológico de la tiña capitis en 60 al 90 % de los casos, mientras que Microsporum Canis es más prevalente en Europa central y meridional, Arabia Saudita y Latinoamérica (15-17).
La presentación clínica de la infección depende del organismo causante, así como de la respuesta inmune del huésped y del compromiso infeccioso ectotrix o endotrix. En el ectotrix las artrosporas forman una vaina alrededor del tallo piloso, mientras que el endotrix invade el tallo sin destruir la cutícula (18).
Los dermatofitos que típicamente causan infecciones ectotrix son el Microsporum canis, Microsporum audouinii, Trichophyton mentagrophytes y Trichophyton verrucosum (19).La mayoría de las especies antropofílicas en particular Trichophyton tonsurans, dan lugar a infecciones por endotrix, que dada la ubicación de las esporas dentro del tallo del cabello sólo generan una débil respuesta inmunogénica, asociándose únicamente a descamación pitiriasiforme del cuero cabelludo, sin eritema, y con pequeños puntos negros o «black dot» en los orificios foliculares del cuero cabelludo. Los pelos restantes están llenos de esporas con una cutícula intacta. Por tal razón, las personas afectadas corren el riesgo de convertirse en portadores asintomáticos (hasta un 15 % de los casos particularmente en adultos) que luego pueden transmitir la infección a otras personas (20).
La invasión folicular profunda por dermatofitos resulta en manifestaciones clínicas graves con pústulas foliculares, secreción purulenta, así como malestar general, fiebre, tricodinia y adenopatías regionales.
Cuando los pacientes se presentan con una placa pseudoalopécica en el cuero cabelludo, friable, dolorosa, con pústulas, nódulos y masiva secreción purulenta como «miel de un panal» la condición se llama querion (en griego, panal de abeja) de Celso (25 a. C. alrededor 50 d.C.), quien fue el que hizo la descripción clínica por primera vez (21).
El querion de Celso tiene un compromiso ectotrix y se considera una respuesta inmunológica celular exagerada al hongo formando granulomas en el cuero cabelludo, en ocasiones se confunde con un absceso bacteriano. Es causado por especies Zoofílicas como Trichophyton verrucosum, Trichophyton mentagrophytes o Trichophyton benhamiae.
En general la tiña capitis no causa alopecia cicatricial y cuando esta aparece es el resultado de una respuesta inflamatoria destructiva y no controlada, particularmente en el contexto de una infección profunda o de larga duración (22).
Diagnóstico
El diagnóstico de la enfermedad se basa en el examen clínico y en pruebas de laboratorio. Se debe realizar una historia clínica detallada especificando el curso de la enfermedad, el compromiso de otros individuos cercanos al paciente, exposición a animales o viajes al extranjero, además, es fundamental indagar por otras manifestaciones de dermatofitosis como tiña del cuerpo u onicomicosis.
La luz de Wood es especialmente útil sobre todo cuando los agentes implicados son Microsporum audouinii y Microsporum canis, donde emitirán una fluorescencia amarillo-verdosa característica (Ver figura 2). Desafortunadamente Trichophyto tonsurans no emite ningún tipo de fluorescencia y ello limita la precisión diagnóstica del estudio (23).
Por otro lado, una de las pruebas más importantes para el diagnóstico de infección por dermatofitos es la visualización directa bajo microscopía de las hifas. Se recolectan escamas con una hoja de bisturí, se colocan en el centro de un portaobjetos, se pone un cubreobjetos y se aplica hidróxido de potasio (KOH) solución del 5 % al 20 %. La preparación debe calentarse suavemente a fuego lento. El hidróxido de potasio disuelve el material que une las células, pero no distorsiona las células epiteliales ni las hifas. Los dermatofitos se reconocerán como septados, en forma de tubo con hifas y micelios.
Una ligera rotación hacia adelante y hacia atrás de la perilla de enfoque puede ayudar en la visualización de todo el segmento de las hifas, que puede estar a diferentes profundidades. La limitación de este examen radica en su baja sensibilidad sobre todo en manos no expertas (24).
El cultivo para hongos es el estándar de oro que confirma el diagnóstico. (25) El medio que se usa normalmente es el agar Sabouraud, suplementado con cloranfenicol o cicloheximida; estos ingredientes ayudan a suprimir el crecimiento de bacterias y mohos que crecerían rápidamente en el medio, donde los dermatofitos crecen más lento.
Las escamas deben colocarse en el agar, mientras que los pelos deben «plantarse» en el medio. Los cultivos se almacenan a temperatura ambiente durante tres a cuatro semanas y seis semanas cuando se sospecha infección por Trichophyton verrucosum, Trichophyton violaceum o Trichophyton soudanense examinándolos a intervalos semanales. La incubación a 37 ° C acelerará el crecimiento de Trichophyton verrucosum (26).
Las colonias obtenidas se clasifican posteriormente en función de su patrón de crecimiento macroscópico, su color o por la formación de microconidias u otros patrones de crecimiento típicos según se determine por microscopía (27). Los métodos moleculares, entre ellos la reacción en cadena de la polimerasa (PCR), son útiles porque permiten identificar de manera precisa la especie de dermatofito y, además, los resultados se obtienen significativamente más rápido (24 a 48 horas frente a 4 a 6 semanas con el cultivo) (28-30).
El estudio histopatológico demuestra la presencia de artrosporas en los folículos pilosos o en el estrato córneo, puede haber crecimiento de hifas y formación de artroconidios en la superficie del pelo (ectotrix) o dentro del tallo (endotrix). Los hallazgos del Querion de Celso pueden clasificarse de acuerdo al patrón inflamatorio como: perifoliculitis, foliculitis supurativa, foliculitis supurativa con dermatitis supurativa y granulomatosa o dermatitis supurativa fibrosante. La tiña no inflamatoria muestra mínimo infiltrado inflamatorio perivascular y perifolicular de predominio linfocitario (31).
La tricoscopia permite una evaluación inicial rápida del paciente y es particularmente útil en situaciones donde no se disponen de pruebas micológicas; la presencia de características distintivas como pelos en coma, pelos de sacacorchos, pelos en código morse, pelos en zigzag, pelos doblados y pelo en bloque son predictivas de Tiña capitis. (32-33).
Otros hallazgos tricoscópicos de Tiña capitis comúnmente observados, pero no específicos incluyen pelos rotos, puntos negros y descamación perifolicular e interfolicular que también pueden detectarse en otras enfermedades del pelo y del cuero cabelludo, como tricotilomanía, alopecia areata, liquen plano pilar, lupus discoide, dermatitis seborreica o psoriasis, por lo que no pueden ser considerados como patognomónicos de la enfermedad. (34)
Diagnóstico Diferencial
Existe una amplia gama de diagnósticos diferenciales a considerar, incluida cualquier afección que se presente con pérdida de pelo en parches, descamación e inflamación del cuero cabelludo. Se incluye la psoriasis, la dermatitis seborreica y la pitiriasis simple o (caspa); En algunas ocasiones estas entidades son difíciles de distinguir clínicamente de la tiña capitis con compromiso inflamatorio leve (35).
Se debe incluir también al lupus discoide, al liquen plano pilar y a la tricotilomanía. Las variantes de tiña capitis inflamatorias pueden diagnosticarse erróneamente como foliculitis bacteriana, forunculosis, carbunclo, foliculitis decalvante o foliculitis pustulosa eosinofílica de la infancia (36).
Tratamiento
El objetivo del tratamiento es lograr la curación clínica y micológica lo más pronto posible, en la mayoría de los casos es necesario el tratamiento con antifúngicos por vía oral. La terapia tópica sola generalmente no se recomienda debido a que las preparaciones de este tipo no alcanzan a penetrar la vaina del pelo de forma suficiente. Sin embargo, puede reducir el riesgo de transmisión al inicio del tratamiento sistémico.
En 1982, Allen y col señalaron que el uso de champú a base de disulfuro de selenio al 2 % era efectivo para reducir el número de esporas viables en cuero cabelludo en pacientes pediátricos tratados concomitantemente con griseofulvina. Más recientemente se han utilizado los champús con ketoconazol al 2 % con resultados similares. Se debe indicar a los pacientes utilizar el champú tres veces por semana y dejarlo en contacto con el cuero cabelludo durante al menos cinco minutos antes de enjuagarlo. Se deberá utilizar hasta que el paciente esté clínica y micológicamente curado (37). Todos los antifúngicos sistémicos son significativamente más eficaces en el tratamiento de la infección endotrix por Trichophyton spp que en infecciones ectotrix por Microsporum spp.
Los diferentes ensayos clínicos controlados han demostrado que la terapia con antifúngicos debe guiarse por la especie causante de la enfermedad; Dosis continuas de itraconazol o terbinafina han mostrado las tasas de curación micológica más altas (38).
La terbinafina debe ser el agente antimicótico preferido para infecciones con Trichophyton spp y el itraconazol o griseofulvina para los causados por Microsporum spp. (39-40. En 1958 Williams y Marten documentaron la eficacia del tratamiento oral con griseofulvina para tiña de la cabeza. Gracias a la introducción del medicamento se pudo abandonar el uso de rayos X, tratamiento utilizado desde finales del siglo XIX cuando fue propuesto por Sabouraud y también se abandonó el uso de acetato de talio (41).
Desde la década de 1960 la griseofulvina es el tratamiento de elección y aunque la dosis/duración del tratamiento pueden variar dependiendo de cada paciente, generalmente se utilizan de 10 a 20 mg/kg/día durante 8 a 12 semanas, aunque se recomiendan dosis más altas para griseofulvina micronizada.
La griseofulvina es fungistática e inhibe la síntesis de ácidos nucleicos, interrumpe la división celular en metafase, impidiendo de esta manera la síntesis de la pared celular del hongo, además también tiene acción antiinflamatoria. Se recomienda tomarla con comidas grasosas para incrementar su absorción y mejorar su biodisponibilidad (42).
Aproximadamente 20 % de los pacientes experimentan efectos adversos, principalmente síntomas gastrointestinales (náuseas y diarrea) así como erupciones exantemáticas y cefalea. Está contraindicada en el embarazo y en pacientes con antecedentes de daño hepático. En general la griseofulvina es segura y efectiva en niños cuando se administran las dosis apropiadas (43).
La Terbinafina es una alilamina fungicida que inhibe la síntesis de ergosterol en la pared celular y aunque es eficaz contra todas las especies de dermatofitos in vitro, ha demostrado ser más eficaz contra Trichophyton spp que contra Microsporum spp. La droga es bien tolerada y no muestra diferencias en el perfil de seguridad en niños en comparación con adultos.
Los efectos adversos incluyen alteraciones gastrointestinales, pérdida del gusto, hepatotoxicidad potencial y reacciones medicamentosas en menos del 8% de los individuos tratados. La dosis depende del peso del paciente y, en general, se recomiendan de 3 a 6 mg/kg/día con una duración del tratamiento de cuatro semanas para tiña de la cabeza en niños, aunque en ocasiones se debe extender incluso hasta por 12 o 16 semanas (44).
El Itraconazol también se utiliza en el manejo de la infección, tiene actividad tanto fungistática como fungicida, dependiendo de su concentración en los tejidos, pero igual que otros azoles su principal mecanismo de acción es fungistático, a través de la depleción del ergosterol de la membrana celular, lo que altera la permeabilidad de la membrana.
Se recomienda a dosis de 100 mg/día por cuatro semanas o 6 mg/kg/día en niños. Es altamente lipofílico y queratinofílico y persiste en el estrato córneo de tres a cuatro semanas después de la suspensión del tratamiento, lo que permite su utilización en pulsos de una semana de duración con dos semanas de descanso entre ellos (45-46).
Es bien tolerado, incluso cuando se utiliza en el primer año de vida. Tiene varias interacciones medicamentosas, al ser inhibidor del citocromo CYP3A4. Cuando se administra concomitantemente con benzodiacepinas, corticoesteroides, estatinas, bloqueadores de canales de calcio, antihistamínicos y algunos antipsicóticos aumenta los niveles de estos (47).
Como última alternativa está el fluconazol, antifúngico con amplio espectro de actividad frente a dermatofitos y candida. Tiene buena biodisponibilidad, baja unión a proteínas y una vida media larga (48).
Es soluble en agua, se absorbe bien independientemente de la ingesta de alimentos y se puede administrar una vez al día, la dosis recomendada es de 5-6 mg/kg/día durante 20 a 30 días, sus efectos adversos más comunes son las náuseas y vómitos, además se pueden elevar las transaminasas, por ello, la función hepática debe solicitarse si se sospecha alguna enfermedad del hígado o se requiere un tratamiento prolongado, sin embargo, el curso relativamente corto requerido para la Tiña Capitis obvia la necesidad de pruebas. Aunque se han realizado menos estudios que evalúan la eficacia del fármaco, parece ser eficaz, sobre todo en infecciones causadas por Trichophyton Tonsurans. (49-50) (Ver tabla 1).
Algunos autores han recomendado el uso de corticoides tópicos, intralesionales u orales, sobre todo en caso severos de Querion de Celso donde el componente inflamatorio extenso puede resultar en una alopecia cicatricial irreversible; Ensayos clínicos aleatorizados realizados por Hussain y col y Ginsburg y col no mostraron diferencias en cuanto al curso de la enfermedad y la respuesta clínica con el uso de prednisolona oral o triamcinolona intralesional concomitante al uso del antifúngico (51-52).
En un estudio retrospectivo, Proudfoot y cols. encontraron que la aplicación tópica de corticosteroides potentes dio como resultado una mejoría más rápida de la inflamación, así como un crecimiento más rápido del pelo; por ello en variantes de Tiña capitis inflamatoria con una respuesta inmunológica intensa y marcado prurito, se puede plantear una terapia tópica con corticosteroides tópicos por un período de 7 a 10 días (53-55).
Para un manejo óptimo de los pacientes con Tiña Capitis se puede seguir una estrategia de tratamiento que incluye: 1) Detección de dermatofito por estudio de KOH, cultivo o PCR. 2) Inicio del tratamiento oral y tópico mínimo durante cuatro semanas. 3) Repetir el cultivo cuatro semanas después de iniciado el tratamiento. 4) Suspender tratamiento oral y continuar con tratamiento tópico hasta que se obtengan los resultados del cultivo de control (solamente se suspende el medicamento oral sí existe una significativa mejoría clínica, en particular, sí el cabello ha comenzado a crecer, de lo contrario, se puede continuar con terapia oral y tópica). 5) En el cultivo hay crecimiento fúngico, continuar el tratamiento oral. 6) Repetir el cultivo cada cuatro semanas hasta que sean negativos.
La curación micológica es el punto final definitivo de cualquier tratamiento adecuado. Por lo tanto, el tratamiento se va ajustando en función de las respuestas individuales de los pacientes.
El monitoreo de laboratorio no se justifica para pacientes sin riesgo sobre todo porque el beneficio de las pruebas no ha sido comprobado en esta población y porque los eventos hepatotóxicos severos ocurren dentro de una ventana de tiempo muy corta y son difíciles de detectar durante el seguimiento (56).
A los pacientes con antecedentes de enfermedad hepática, que ingieren otros medicamentos o con alguna comorbilidad se recomienda medir alanina aminotransferasa (ALT), aspartato aminotransferasa (AST) y gamma-glutamiltranspeptidasa (GGT) antes, durante y después del tratamiento a intervalos de 4 semanas (57-58).
Figura 1. Placa única eritematocostrosa pseudoalopécica. Variante microspórica.
Figura 2. Fluorescencia amarillo-verdosa con luz de Wood.
Tabla 1. Dosis de medicamentos antifúngicos.
|
Griseofulvina |
20-25mg/kg/día |
|
Itraconazol |
3-5mg/kg/día
|
|
Terbinafina |
3-6mg/kg/día o Menos de 20kg: 62.5mg/día (cuarto de tableta) 20 a 40 kg: 125mg/día (media tableta) Mayor a 40kg: 250mg/día (tableta completa)
|
|
Fluconazol
|
3-6mg/kg/día
|
Conclusiones
La tiña de la cabeza es una afección común en los niños, particularmente en aquellos menos favorecidos, la presentación clínica es variable y el diagnóstico debe ser confirmado con cultivo. El abanico de tratamientos es amplio e incluye a la griseofulvina, terbinafina o itraconazol que deben administrarse por varias semanas hasta obtener la cura clínica y micológica de la enfermedad
Referencias
1. Zuluaga A, Cáceres DH, Arango K, De Bedout C, Cano LE. Epidemiología de la tinea capitis: 19 años de experiencia en un laboratorio clínico especializado en Colombia. Infectio. 2016;20(4)225-230.
2. Hay, R. Tinea Capitis: Current Status. Mycopathologia. 2017;182. (1-2), 87–93.
3. Messina, F., Walker, L., Romero, M. de las M., Arechavala, A. I., Negroni, R., Depardo, R et al. Tinea capitis: clinical features and therapeutic alternatives. Rev Argent Microbiol. 2021;19:S0325- 7541(21)00011-0.
4. Kechia FA, Kouoto EA, Nkoa T, Nweze EI, Fokoua DC, Fosso S, Somo MR. Epidemiology of tinea capitis among school-age children in Meiganga, Cameroon. J Mycol Med. 2014;24(2):129- 34.
5. Abdel-Rahman SM, Farrand N, Schuenemann E, et al. The prevalence of infections with Trichophyton tonsurans in schoolchildren: the CAPITIS study. Pediatrics 2010;125: 966-973.
6. Monod M, Fratti M, Mignon B, et al. Dermatophytes transmitted by pets and cattle. Rev Med Suisse 2014;10:749-753.
7. Mirmirani P, Tucker LY. Epidemiologic trends in pediatric tinea capitis: a population-based study from Kaiser Permanente Northern California. J Am Acad Dermatol 2013;69: 916–921.
8. Zaraá I, Hawilo A, Aounallah A, Trojjet S, El Euch D, Mokni M et al. Inflammatory Tinea capitis: a 12-year study and a review of the literature. Mycoses. 2013;56(2)110-6.
9. Mao L, Zhang L, Li H, et al. Pathogenic fungus Microsporum canis activates the NLRP3 inflammasome. Infect Immun 2014;82:882–892.
10. Takwale A, Agarwal S, Holmes SC, et al. Tinea capitis in two elderly women: transmission at the hairdresser. Br J Dermatol 2001;144:898-900.
11. Aly R. Ecology, epidemiology, and diagnosis of tinea capitis. Pediatr Inf Dis J 1999; 18:180-185.
12. Brendan K. Superficial fungal infections. Pediatr Rev. 2012;33:e22-37.
13. Negroni R, Arechavala A. Micosis superficiales de la piel y sus faneras. En: Lecciones de clínica micológica. 2 da ed Editorial Ascune; 2019. p.15-33.
14. Möhrenschlager M, Bruckbauer H, Seidl HP, Ring J, Hofmann H. Prevalence of asymptomatic carriers and cases of tinea capitis in five- to six-year-old preschool children from Augsburg, Germany: results from the MIRIAM study. Pediatr Infect Dis J. 2005;24:749-50.
15. Panasiti V, Devirgiliis V, Borroni RG et al. Epidemiology of dermatophytic infections in Rome, Italy: a retrospective study from 2002 to 2004. Med Mycol 2007;45:57–60.
16. Fuller LC. Changing face of tinea capitis in Europe. Curr Opin Infect Dis 2009;22: 115-8.
17. Veasey J, Miguel B, Mayor S, Zaitz C, Muramatu L and Serrano J. Epidemiological profile of tinea capitis in São Paulo City. Anais Brasileiros de Dermatologia. 2017;92(2), 283-284.
18. Proudfoot LE, Higgins EM, Morris-Jones R. A retrospective study of the management of pediatric kerion in Trichophyton tonsurans infection. Pediatr Dermatol 2011; 28: 655-7.
19. Pomeranz AJ, Fairley JA. Management error leading to unnecessary hospitalization for kerion. Pediatrics 1994; 93: 968-88.
20. Fuller LC, Child FJ, Midgley G, Higgins EM. Diagnosis and management of scalp ringworm. BMJ 2003; 326: 539–41.
21. Zhang R, Ran Y, Dai Y et al. A case of kerion celsi caused by Microsporum gypseum in a boy following dermatoplasty for a scalp wound from a road accident. Med Mycol 2011; 49: 90–3.
22. Nenoff P, Kruger C, Schulze I et al. [Tinea capitis and onychomycosis due to Trichophyton soudanense: Successful treatment with fluconazole-literature review]. Hautarzt 2018; 69:737–50.
23. Burke WA, Jones BE. A simple stain for rapid office diagnosis of fungus infection of the skin. Arch Dermatol 1984;120:1519.
24. Head ES, Henry JC, MacDonald EM. The cotton swab technique for the culture of dermatophyte infections: its efficacy and merit. J Am Acad Dermatol 1984;11:797.
25. Hiruma J, Ogawa Y, Hiruma M. Trichophyton tonsurans infection in Japan: epidemiology, clinical features, diagnosis and infection control. J Dermatol 2015;42: 245–249.
26. Robert R, Pihet M. Conventional methods for the diagnosis of dermatophytosis. Mycopathologia 2008;166:295–306.
27. Verrier J, Krahenbuhl L, Bontems O et al. Dermatophyte identification in skin and hair samples using a simple and reliable nested polymerase chain reaction assay. Br J Dermatol 2013;168:295–301.
28. Sugita T, Shiraki Y, Hiruma M. Real-time PCR TaqMan assay for detecting Trichophyton tonsurans, a causative agent of tinea capitis, from hairbrushes. Med Mycol 2006;44:579–81.
29. Verrier J, Monod M. Diagnosis of dermatophytosis using molecular biology. Mycopathologia 2017;182:193–202.
30. Ghannoum MA, Wraith LA, Cai B et al. Susceptibility of dermatophyte isolates obtained from a large worldwide terbinafine tinea capitis clinical trial. Br J Dermatol 2008;159:711–3.
31. Arenas R, Toussaint S, Isa-Isa R. Kerion and dermatophytic granuloma. Mycological and histopathological findings in 19 children with inflammatory tinea capitis of the scalp. Int J Dermatol. 2006;45(3):215-9.
32. Vazquez-Lopez F, Palacios-Garcia L, Argenziano G. Dermoscopic corkscrew hairs dissolve after successful therapy of Trichophyton violaceum tinea capitis: a case report. Australas J Dermatol. 2012;53:118–9.
33. Richarz NA, Barboza L, Monsonis M et al. Trichoscopy helps to predict the time point of clinical cure of tinea capitis. Australas J Dermatol 2018;59: e298–e299.
34. Waśkiel-Burnat A, Rakowska A, Sikora M, Ciechanowicz P, Olszewska M, Rudnicka L. Trichoscopy of Tinea Capitis: A Systematic Review. Dermatol Ther (Heidelb). 2020; 10(1):43-52.
35. Seebacher C, Abeck D, Brasch J et al. Tinea capitis: ringworm of the scalp. Mycoses. 2007;50.218–26.
36. Fuller LC, Barton RC, Mohd Mustapa MF et al. British Association of Dermatologists’ guidelines for the management of tinea capitis 2014. Br J Dermatol 2014;171:454–63.
37. Allen h, Honig P, Leyden J and McGinley K. Selenium sulfide: adjunctive therapy for tinea capitis. Pediatrics, 69 (1982), pp. 81-83.
38. Gupta AK, Mays RR, Versteeg SG et al. Tinea capitis in children: a systematic review of management. J Eur Acad Dermatol Venereol 2018;32:2264-74.
39. Gupta AK, Adam P, Dlova N et al. Therapeutic options for the treatment of tinea capitis caused by Trichophyton species: griseofulvin versus the new oral antifungal agents, terbinafine, itraconazole, and fluconazole. Pediatr Dermatol 2001;18:433-8.
40. Chen X, Jiang X, Yang M et al. Systemic antifungal therapy for tinea capitis in children: An abridged Cochrane Review. J Am Acad Dermatol 2017;76:368-74.
41. B.E. Elewski. Cutaneous mycoses in children. Br J Dermatol, 134 (1996), pp. 7-11.
42. Gupta AK, Mays RR, Versteeg SG et al. Tinea capitis in children: a systematic review of management. J Eur Acad Dermatol Venereol 2018; 32:2264–74.
43. Chen X, Jiang X, Yang M et al. Systemic antifungal therapy for tinea capitis in children: An abridged Cochrane Review. J Am Acad Dermatol 2017;76: 368–74.
44. F. Baudrez-Rosselet, M. Monod, S. Jaccoud, E. Frenk. Efficacy of terbinafine treatment of tinea capitis in children varies according to the dermatophyte species. Br J Dermatol. 1996;135(1996)1011-1012.
45. Higgins EM, Fuller LC, Smith CH. Guidelines for the management of tinea capitis. British Association of Dermatologists. Br J Dermatol. 2000;143(1):53-8.
46. Gupta AK, Mays RR, Versteeg SG et al. Tinea capitis in children: a systematic review of management. J Eur Acad Dermatol Venereol 2018;32:2264-74.
47. Gubbins PO, Heldenbrand S. Clinically relevant drug interactions of current antifungal agents. Mycoses 2010; 53: 95- 113.
48. Solomon BA, Collins R, Sharma R, Silverberg N, Jain AR, Sedgh J, Laude TA. Fluconazole for the treatment of tinea capitis in children. J Am Acad Dermatol. 1997;37(2 Pt 1):274-5.
49. Silverman R. Using oral antifungals safely. Contemp Pediatr 2001;18:9-11.
50. Blumer JL. Pharmacologic basis for the treatment of tinea capitis. Pediatr Infect Dis J.1999;18:191-9.
51. Hussain I, Muzaffar F, Rashid T et al. A randomized, comparative trial of treatment of kerion celsi with griseofulvin plus oral prednisolone vs. griseofulvin alone. Med Mycol.1999;37:97-9.
52. Ginsburg CM, Gan VN, Petruska M. Randomized controlled trial of intralesional corticosteroid and griseofulvin vs. griseofulvin alone for treatment of kerion. Pediatr Infect Dis J. 1987;6:1084-7.
53. Proudfoot LE, Higgins EM, Morris-Jones R. A retrospective study of the management of pediatric kerion in Trichophyton tonsurans infection. Pediatr Dermatol. 2011;28:655–7.
54. Mayser P. Treatment of dermatoses: Significance and use of glucocorticoids in fixed combination with antifungals. Hautarzt 2016; 67:732-8.
55. Schaller M, Friedrich M, Papini M et al. Topical antifungalcorticosteroid combination therapy for the treatment of superficial mycoses: conclusions of an expert panel meeting. Mycoses 2016;59:365-73.
56. Stolmeier DA, Stratman HB, McIntee TJ, Stratman EJ. Utility of laboratory test result monitoring in patients taking oral terbinafine or griseofulvin for dermatophyte infections. JAMA Dermatol 2018; 154: 1409-16.
57. Patel D, Castelo-Soccio LA, Rubin AI, Streicher JL. Laboratory monitoring during systemic terbinafine therapy for pediatric onychomycosis. JAMA Dermatol. 2017;153: 1326-7.
58. Kramer ON, Albrecht J. Clinical presentation of terbinafineinduced severe liver injury and the value of laboratory monitoring: a critically appraised topic. Br J Dermatol .2017; 177:1279-84.
59. Cestari T, Manzoni A. Patología infecciosa. En: Larralde M, Abad E, Luna P, Boggio P, Ferrari B, editores. Dermatología Pediátrica. 3a ed. Ciudad Autónoma de Buenos Aires: Journal; 2021. p.174- 266.