Pediatría
ISSN impreso: 0120-4912
e-ISSN: 2444-9369
DOI: 10.14295/rp.v57i3.574
Artículo de Revisión
Consenso académico de Prácticas de impacto de la lactancia en Colombia
Colombian Academic Consensus on Breastfeeding Impact Practices
Nancy Milena Bernala ![]() ,
Carlos Timossib
,
Carlos Timossib![]() , María Mercedes Pulidoc
, María Mercedes Pulidoc![]() , María Isabel
Uscherd
, María Isabel
Uscherd ![]() , Luz Stella Hidalgoe
, Luz Stella Hidalgoe ![]() , Carolina Gómezf
, Carolina Gómezf ![]() ,
María Emilia Contrerasg
,
María Emilia Contrerasg ![]()
a. Pediatra, epidemióloga, consultora internacional en lactancia materna IBCLC, Asociación Colombiana de Nutrición Clínica. Correo electrónico: nmbernal1@fucsalud.edu.co
b. Doctor en Ciencias Biomédicas, Químico Bioquímico, Community Sci Advisor LASPGHAN, facilitador del estudio, Plataforma Delphi. Correo electrónico: ctimossi@gmail.com
c. Pediatra, neonatóloga, Asociación Colombiana de Neonatología. Correo electrónico: mmpulido@fucsalud.edu.co
d. Pediatra, Sociedad Colombiana de Pediatría, expresidente regional Bogotá. Correo electrónico: miuscher@me.com
e. Nutricionista dietista, especialista en nutrición clínica, docente universitaria, Asociación Colombiana de Nutrición Clínica. Correo electrónico: luzstellahidalgoneira@gmail.com
f. Nutricionista dietista, consultora internacional en lactancia materna IBCLC, Asociación Colombiana de Nutrición Clínica. Correo electrónico: carogomezjara@gmail.com
g. Pediatra, consultora internacional en lactancia materna IBCLC, Sociedad Colombiana de Pediatría. Correo electrónico: mcontrerassocarras@gmail.com
Fecha de recepción: 26 de octubre de 2024
Fecha de aceptación: 10 de enero de 2025
Cómo citar: Bernal NM, Timossi C, Pulido MM, Uscher MI, Hidalgo LS, Gomez C, Contreras ME. Consenso académico de Prácticas de impacto de la lactancia en Colombia. Pediatr. 2024;57(3):e574.
Autor de correspondencia: Nancy Milena Bernal. Correo: nmbernal1@fucsalud.edu.co
Editor en jefe: Álvaro Jácome Orozco
Resumen
Introducción: La Sociedad Colombiana de Pediatría y la Asociación Colombiana de Nutrición Clínica reúne especialistas con el objetivo de llegar a acuerdos nacionales sobre tópicos relevantes y controversiales en lactancia, los cuales impactan el desarrollo y crecimiento de la población infantil.
Metodología: El grupo formuló 53 declaraciones controversiales tras una revisión exhaustiva de la literatura reciente. El panel contó con 44 especialistas de quince agremiaciones científicas y entidades no gubernamentales, destacando su enfoque multidisciplinario y representación regional. El proceso Delphi se realizó en una plataforma ad-hoc, con discusiones en línea. Los panelistas calificaron las declaraciones anónimamente en escala Likert de cinco puntos, estableciendo un consenso a priori del 85% de coincidencias. Cada participante justificó sus respuestas y se utilizó el coeficiente alfa de Cronbach para evaluar la consistencia interna, fijando en > 0,80 el criterio para la ronda final de consenso.
Resultados: Se realizaron dos rondas de discusión. El total de declaraciones alcanzó más del 85 % de consenso, con un alfa de Cronbach de 0.95.
Conclusiones: La evidencia científica respalda los beneficios de la lactancia, aunque persisten controversias. Este consenso brinda al profesional más herramientas para ayudar a las familias a tomar decisiones informadas. El uso del método Delphi en tiempo real permite la participación de expertos de todas las regiones del país con un análisis de datos objetivo y confiable. Estos resultados sientan una base de discusión para el análisis y soporte a las prácticas de lactancia materna en Colombia.
Palabras Clave: Método Delphi, Consenso, Lactancia materna, Nutrición.
Abstract
Introduction: The Colombian Society of Pediatrics and the Colombian Association of Clinical Nutrition have gathered specialists with the aim of reaching national agreements on relevant and controversial topics in breastfeeding, which impact the development and growth of the infant population.
Methodology: The working group formulated 53 controversial statements following a comprehensive review of recent literature. The panel consisted of 44 specialists from fifteen associations and non-governmental organizations, emphasizing its multidisciplinary approach and regional representation. The Delphi process was conducted on a dedicated platform with online real-time discussions. Panelists anonymously rated the statements on a five-point Likert scale, with a pre-established consensus threshold of 85 % agreement. Each participant provided justification for their responses, and Cronbach's alpha coefficient was used to assess internal consistency, with a threshold of > 0.80 set for the final consensus round.
Results: Two rounds of discussion were conducted. All statements achieved more than 85% consensus, with a Cronbach’s alpha of 0.95.
Conclusions: Scientific evidence supports the benefits of breastfeeding, though controversies remain. This consensus provides healthcare professionals with additional tools to help families make informed decisions. The use of the real-time Delphi method allowed for the participation of experts from across the country, ensuring an objective and reliable data analysis. These results establish a basis for discussion, analysis, and support of breastfeeding practices in Colombia.
Keywords: Delphi Method, Consensus, Breastfeeding, Nutrition.
Introducción
Existe amplia evidencia que respalda los beneficios de la lactancia materna (1,2) y se dispone de lineamientos y guías tanto nacionales como internacionales (3,4,5). Sin embargo, en la práctica clínica se observa que gran parte de las recomendaciones no se aplican de manera consistente, especialmente en temas que suelen considerarse controversiales.
Con el fin de abordar estos desafíos, la Sociedad Colombiana de Pediatría (SCP) y la Asociación Colombiana de Nutrición Clínica (ACNC) reunieron a un panel de expertos de diversas disciplinas y de todas las regiones de Colombia para generar acuerdos en torno a estos tópicos, alineados con los Objetivos de Desarrollo Sostenible, en especial el ODS 2: Hambre Cero, que busca mejorar la nutrición y promover prácticas alimentarias saludables (6).
El desarrollo de este consenso facilita la implementación y aplicación adecuada de guías, lineamientos, políticas públicas, desarrollos programáticos y las agendas regionales, nacionales e internacionales ya establecidas sobre lactancia (7). Además, busca fortalecer la puesta en práctica de dichas guías por parte de todos los profesionales de la salud, unificando conceptos desde múltiples disciplinas.
Se utilizó la técnica Delphi, un método de pronóstico o toma de decisiones que emplea un proceso estructurado de comunicación anónima entre un grupo de expertos con el fin de llegar a consenso sobre un tema específico (8, 9). La técnica Delphi se utiliza ampliamente en el campo de la salud para la toma de decisiones, especialmente en áreas donde la incertidumbre es alta y se requiere la opinión de expertos (10).
Metodología
El grupo desarrollador del consenso, compuesto por expertos del comité de lactancia de la Sociedad Colombiana de Pediatría y la Asociación Colombiana de Nutrición Clínica, llevó a cabo un análisis crítico de la literatura especializada. A partir de este análisis, se formularon 53 declaraciones sobre temas controversiales en el ámbito de la lactancia materna, las cuales fueron presentadas para votación.
El panel de expertos, convocado por 15 agremiaciones, estuvo compuesto por 44 especialistas seleccionados por la presidencia de cada sociedad científica de las áreas de pediatría, neonatología, infectología pediátrica, gastroenterología pediátrica, obstetricia, perinatología, fonoaudiología, nutrición, enfermería, psicología perinatal, odontopediatría, terapia ocupacional y UNICEF.
Se realizó una revisión cualitativa sistemática de la literatura actual en bases de datos como PubMed, Scopus, MEDLINE, SCIELO y Web of Science, buscando artículos originales de texto completo en inglés y español, utilizando términos MESH específicos para cada declaración. La bibliografía sugerida y las declaraciones fueron enviadas previamente a los expertos para respaldar sus respuestas y ampliar la búsqueda de literatura especializada.
Los participantes firmaron un acuerdo de confidencialidad para proteger información sensible, fomentar la participación abierta, evitar conflictos de interés, mantener la integridad del proceso y cumplir con las regulaciones éticas, garantizando así un proceso transparente y objetivo para todas las partes involucradas. No fue necesaria la evaluación por un comité de ética, ya que el estudio no utilizó datos de pacientes ni material biológico.
El proceso Delphi se llevó a cabo a través de una plataforma ad-hoc, con discusiones en línea en tiempo real (9). Los panelistas calificaron de forma anónima las declaraciones asignadas según su especialidad, utilizando una escala Likert de cinco puntos (1 - totalmente en desacuerdo, 2 - en desacuerdo, 3 - neutral, 4 - de acuerdo, 5 - totalmente de acuerdo). El consenso se definió a priori con un 85% de coincidencia entre respuestas. Cada panelista debía justificar sus respuestas. Además, de acuerdo con los procesos establecidos de Delphi, se presentaban cuadros de texto después de que los panelistas ingresaban su votación a cada declaración, permitiéndoles proporcionar comentarios y sugerir modificaciones, estos fueron revisados y utilizados para ajustar las declaraciones en rondas de encuestas posteriores. Al facilitador del estudio no se le permitió votar ni comentar las declaraciones.
Se utilizó el coeficiente alfa de Cronbach para determinar la consistencia interna de la herramienta de evaluación después de cada ronda. El valor alfa de Cronbach demuestra qué tan estrechamente relacionados están un conjunto de elementos de la prueba como grupo y varía entre 0 y 1, donde 1 corresponde al 100% de consistencia. La ronda final del consenso se definió al alcanzar un alfa de Cronbach > 0,80. Las variables categóricas se expresaron como proporciones (%) (11).
Las fases del desarrollo del consenso se resumen en la figura 1.
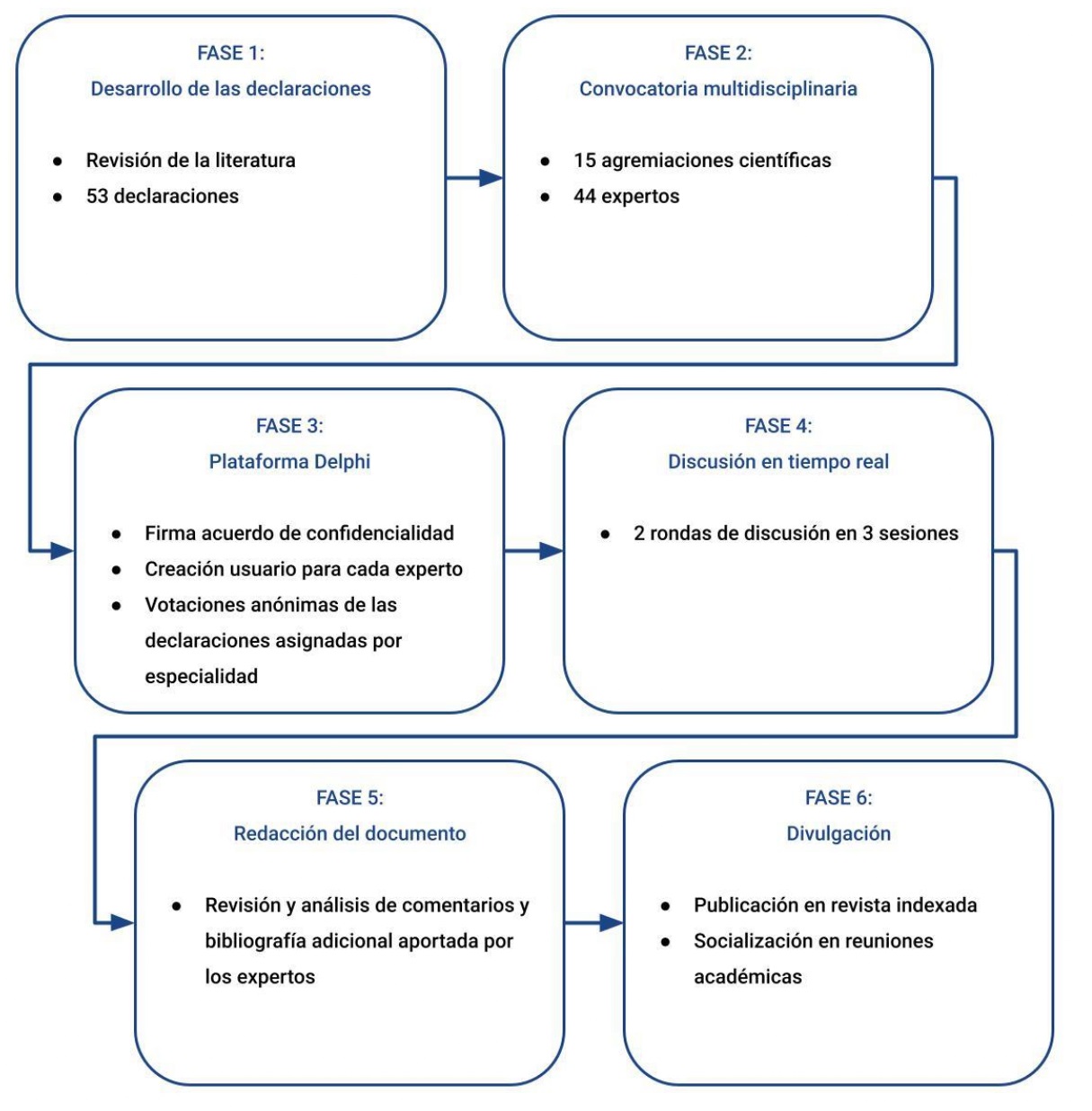
Figura 1. Fases de desarrollo del consenso.
Resultados
Se realizaron dos rondas de discusión abierta, en 3 sesiones, luego de la segunda ronda se obtuvo consenso y el total de declaraciones alcanzó más del 85 % de acuerdo, con un alfa de Cronbach de 0.95.
Un total de ocho declaraciones fueron ajustadas y mejoradas en su redacción durante las discusiones del consenso, lo que facilitó su claridad y comprensión. Estas declaraciones modificadas se sometieron a una nueva votación tras la primera ronda y se debatieron en la segunda, permitiendo alcanzar el consenso con las respectivas modificaciones.
A continuación, se presenta cada declaración junto con el porcentaje de coincidencia obtenido. Tabla 1.
Tabla 1. Declaraciones del consenso
|
Sección |
Declaraciones |
Consenso |
|
Asesoría y decisiones informadas |
Declaración 1: Es fundamental que todos los profesionales de la salud conozcan y apliquen el Código Internacional de Comercialización de Sucedáneos de la Leche Materna. Hacerlo asegura que se brinde una orientación clara y sin sesgos sobre la lactancia materna, lo cual permite a las familias tomar decisiones informadas respecto a la nutrición de sus hijos. |
98 % 1era ronda |
|
Declaración 2: Los profesionales de la salud deben dar a conocer a toda mujer embarazada sobre las ventajas de amamantar y brindar información sobre los riesgos de utilizar fórmula infantil. |
98 % 1era ronda |
|
|
Declaración 3: En caso de no existir contraindicación absoluta para la lactancia materna, si la madre manifiesta su intención de alimentar a su hijo con fórmula infantil, es responsabilidad del profesional de la salud proporcionar información adecuada sobre los riesgos asociados a esta práctica, para que la madre pueda tomar decisiones informadas y conscientes. |
100 % 1era ronda |
|
|
Asesoría prenatal |
Declaración 4: La identificación del tipo de pezón por parte del profesional de la salud es una práctica rutinaria, será válida, siempre y cuando no se emitan juicios de valor, como por ejemplo, decir que no se puede alimentar correctamente debido a que el pezón es plano, entre otros comentarios similares. Es importante recordar que es el recién nacido quien, a través de la succión, facilitará el proceso de alimentación. |
94 % 2da ronda Modificada en redacción |
|
Declaración 5: La extracción prenatal de calostro a partir de la semana 36 de gestación puede resultar de ayuda para aquellas mujeres que presentan riesgo de retraso en la lactogénesis II. |
89 % 2da ronda Requirió argumentación adicional por gineco obstetras y perinatólogos |
|
|
Declaración 6: Las cirugías de las mamas como mamoplastia de aumento o reducción y mastectomía parcial, no representan contraindicación para la lactancia materna exclusiva. |
93 % 1era ronda
|
|
|
Lactancia durante gestación y en Tándem |
Declaración 7: No se recomienda suspender la lactancia durante una nueva gestación excepto en amenaza de aborto o amenaza de parto pretérmino. |
98 % 1era ronda |
|
Declaración 8: Practicar el amamantamiento de manera simultánea a dos niños de diferentes edades es una práctica segura que no implica riesgos nutricionales ni de salud tanto para la madre como para los lactantes. |
93 % 1era ronda |
|
|
Libre demanda |
Declaración 9: En los bebés sanos la lactancia humana debe darse a libre demanda, lo que implica ofrecer el pecho tantas veces y durante el tiempo que el bebé desee. |
98 % 1era ronda |
|
Declaración 10: Se aconseja que un recién nacido sea amamantado al menos 8 veces en el transcurso de 24 horas. |
98 % 1era ronda |
|
|
Declaración 11: No existe una duración fija para las tomas de leche materna del recién nacido, por lo que se deben valorar los signos de saciedad y satisfacción para determinar la duración adecuada. |
93 % 1era ronda |
|
|
Declaración 12: Es fundamental que el profesional de la salud pueda reconocer y evaluar de manera efectiva las señales que indican una adecuada transferencia de leche materna durante la lactancia, tales como la presencia de series repetidas de succiones profundas, rítmicas y coordinadas, con intervalos de pausa y evidencia de deglución, que puede ser audible o no, especialmente en recién nacidos. |
100 % 1era ronda |
|
|
|
Declaración 13: En el caso de lactantes sanos a término, se espera que durante el primer día de vida la ingesta promedio de calostro por toma oscile entre 2 y 10 ml, aumentando a medida que pasan los días. Por ello, es importante que las expectativas sobre la producción de leche materna tomen en cuenta este aspecto. |
98 % 1era ronda |
|
Valoración de la lactancia |
Declaración 14: Se debe valorar la eficacia de la lactancia materna en la primera hora de vida del recién nacido y posteriormente una vez en el periodo de alojamiento conjunto, en las horas previas al alta hospitalaria de la madre y el bebé. |
97 % 1era ronda |
|
Declaración 15: La valoración de la lactancia y efectividad de la toma, debe ser realizada por un profesional con formación en consejería en lactancia materna. |
93 % 2da ronda Discusión sobre la formación del profesional. |
|
|
Declaración 16: En la valoración ambulatoria del recién nacido, que se realiza entre el tercer y quinto día de vida, se debe evaluar la técnica de lactancia materna y su efectividad, por un profesional con formación en consejería en lactancia materna. |
91 % 1era ronda |
|
|
Declaración 17: Previo al alta hospitalaria, es importante que se realice una evaluación completa de la lactancia materna, que debe quedar registrada en la historia clínica del recién nacido. Dicha evaluación debe incluir, como mínimo, una lista de verificación que contemple la evaluación de la posición de la madre y del bebé durante el amamantamiento, la valoración del agarre del lactante para succionar adecuadamente, la evaluación de la transferencia de leche materna, la observación de la presencia de meconio y orina en el recién nacido |
100 % 1era ronda |
|
|
Declaración 18: Previo al alta hospitalaria, la valoración de la lactancia debe incluir un instrumento que permita evaluar la autoeficacia en la madre. |
100 % 1era ronda |
|
|
Extracción |
Declaración 19: Previo al alta hospitalaria, es importante proporcionar a la madre entrenamiento para realizar la extracción de leche materna de manera manual y su almacenamiento con seguridad y eficacia. |
95 % 1era ronda |
|
Suplementación |
Declaración 20: No se debe proporcionar a los recién nacidos en alojamiento conjunto ningún alimento o líquido oral que no sea leche materna, sin previa valoración de la efectividad de la lactancia por profesional experto. |
95 % 1era ronda |
|
Declaración 21: En caso de ser necesaria la suplementación, la primera opción para alimentar a un bebé que no logra el aporte mediante succión directa del pecho, debe ser la administración de leche humana extraída. |
97 % 1era ronda |
|
|
Aditamentos de la lactancia |
Declaración 22: Se recomienda evitar el uso del chupo de biberón o chupo de entretención al menos el primer mes de vida, y hasta que la lactancia materna esté consolidada. |
98 % 1era ronda |
|
Declaración 23: Se desaconseja el uso de pezoneras de forma rutinaria para disminuir dolor, por tipo de pezón, o con la intención de mejorar el agarre, en su lugar se requiere una evaluación e intervención desde la adecuada consejería en lactancia |
100 % 2da ronda Modificada en redacción |
|
|
Declaración 24: No existe evidencia concluyente que demuestre indicaciones claras, efectividad y seguridad del uso de las pezoneras. Por lo tanto, el profesional de la salud debe tener precaución al recomendar este accesorio, utilizándolo como última opción y solo cuando se haya constatado que el agarre sigue siendo inadecuado después de una intervención en lactancia. |
100 % 2da ronda Modificada en redacción |
|
|
Declaración 25: El empleo de pezoneras debe ser temporal, ya que puede disminuir la transferencia de leche y, por ende, comprometer la nutrición del recién nacido. Además, se requiere una estrecha monitorización durante su utilización. |
97 % 1era ronda |
|
|
Anquiglosia |
Declaración 26: Un frenillo sublingual no siempre interfiere con el amamantamiento y solo si se evidencia anquiloglosia, se requiere una intervención desde terapia con fonoaudiología hasta frenotomía de acuerdo a lo requerido en cada caso. |
91 % 1era ronda
|
|
Pérdida de peso |
Declaración 27: Un porcentaje de pérdida de peso mayor al 7% después del segundo día de vida, puede sugerir dificultad en el proceso de amamantamiento y requiere evaluación cuidadosa del recién nacido e intervención en la lactancia. |
100 % 1era ronda
|
|
Declaración 28: La principal intervención en los recién nacidos amamantados y con pérdida de peso superior al 7% entre el 3er y 5to día de vida es la evaluación integral del amamantamiento y se debe implementar corrección de las dificultades identificadas. |
95 % 1era ronda |
|
|
Declaración 29: Si se detecta una pérdida de peso superior al 7% entre el tercer y quinto día de vida, es necesario realizar un seguimiento entre 48 y 72 horas después de intervenir en la lactancia. |
100 % 1era ronda |
|
|
Declaración 30: En un recién nacido amamantado de manera exclusiva, la pérdida de peso mayor al 7 - 10% sin signos de deshidratación o ictericia no necesariamente es motivo de hospitalización y separación del binomio madre-hijo, requiere intervención en la lactancia. |
91 % 1era ronda |
|
|
Declaración 31: La recuperación del peso al nacer en un recién nacido amamantado de manera exclusiva y a libre demanda, debe darse entre los 10 a 21 días de vida. |
88 % 2da ronda Modificada en redacción y discusión de evidencia |
|
|
Declaración 32: Si un recién nacido amamantado de manera exclusiva y a libre demanda no logra la recuperación del peso al nacer entre los 10 a 21 días de vida, se requiere realizar una evaluación exhaustiva de la lactancia y descartar patología mamaria o propia del recién nacido y no necesariamente es indicación de suplementación con fórmula. |
98 % 1era ronda |
|
|
Declaración 33: La deshidratación hipernatrémica del recién nacido asociada a lactancia materna exclusiva, se puede prevenir educando a las madres sobre las técnicas de lactancia materna desde el período prenatal y en la estancia hospitalaria tras el parto. |
98 % 1era ronda |
|
|
Hipoglicemia |
Declaración 34: La toma de glucometría no se debe realizar de manera rutinaria en recién nacidos sanos, excepto en aquellos con riesgo de hipoglucemia como: pretérmino tardío, a término pequeño para la edad gestacional, hijos de madre diabética o grandes para la edad gestacional. |
95 % 1era ronda |
|
Declaración 35: Los lactantes con factores de riesgo para hipoglucemia como: pretérmino tardío, a término pequeño para la edad gestacional, hijos de madre diabética o grandes para la edad gestacional, que se encuentren asintomáticos deben continuar siendo amamantados con la recomendación de alimentar cada 2 a 3 horas las primeras 24 a 72 horas de vida. |
100 % 1era ronda |
|
|
Declaración 36: Los lactantes con factores de riesgo para hipoglucemia como: pretérmino tardío, a término pequeño para la edad gestacional, hijos de madre diabética o grandes para la edad gestacional, que se encuentren asintomáticos no requieren suplementación de rutina con líquidos dextrosados o fórmula infantil. |
92 % 1era ronda |
|
|
Declaración 37: En los lactantes con factores de riesgo para hipoglucemia como: pretérmino tardío, a término pequeño para la edad gestacional, hijos de madre diabética o grandes para la edad gestacional; se debe verificar la técnica de amamantamiento y adecuada transferencia de leche antes del alta hospitalaria, dejar claras las señales de alarma y garantizar el control en las primeras 48 a 72 horas. |
97 % 1era ronda Modificada en redacción |
|
|
Lactancia a libre demanda y alimentación complementaria |
Declaración 38: Con el inicio e instauración de la alimentación complementaria, la leche materna se debe continuar ofreciendo a libre demanda (Sin horarios ni tiempos establecidos de duración). |
93 % 1era ronda |
|
Declaración 39: La lactancia materna debe mantenerse y protegerse como un alimento óptimo y ofrecerse a libre demanda en cualquier edad, independientemente del estado nutricional del niño, incluyendo situaciones de malnutrición como bajo peso, desnutrición, sobrepeso u obesidad; siguiendo con el tratamiento y seguimiento correspondiente a su condición individual. |
93 % 2da ronda Modificada en redacción y discusión multidisciplinaria |
|
|
Declaración 40: La lactancia materna no es la causa de los patrones selectivos de alimentación observados en algunos niños. Por lo tanto, no debe restringirse o suspenderse; en su lugar, se debe investigar y abordar la causa subyacente. |
97 % 1era ronda |
|
|
Lactancia y sueño |
Declaración 41: No se aconseja interrumpir la lactancia materna durante la noche con el objetivo de optimizar los patrones de sueño, dado que la estructura y organización del sueño son procesos de maduración que se desarrollan de manera independiente al amamantamiento. |
100 % 1era ronda |
|
Declaración 42: En un bebé amamantado a libre demanda, la succión nocturna favorece el mantenimiento de la lactancia. |
98 % 1era ronda |
|
|
Declaración 43: No se recomienda administrar suplementos o fórmulas infantiles con la intención de extender los períodos de sueño del lactante. Intentar retrasar el vaciamiento gástrico para mantener al bebé más lleno de lo habitual no altera su proceso de maduración y, por lo tanto, no es aconsejable. |
100 % 1era ronda |
|
|
Colecho
|
Declaración 44: El colecho seguro beneficia la fisiología del sueño en los lactantes, aumenta la tasa de amamantamiento y mejora el descanso materno. |
93 % 1era ronda |
|
Declaración 45: Como profesional de la salud, la recomendación respecto al colecho se centra en proporcionar orientaciones para su práctica segura. La decisión de adoptar el colecho corresponde a cada familia. |
98 % 1era ronda |
|
|
Lactancia materna continuada |
Declaración 46: No es necesario suspender la lactancia a una edad determinada; es una decisión de la familia lactante. |
93 % 1era ronda |
|
Declaración 47: Es importante conocer las ventajas de continuar con la lactancia materna después de los dos años, para que los padres puedan tomar decisiones informadas al respecto. |
100 % 1era ronda |
|
|
APLV |
Declaración 48: Cuando existe un diagnóstico o sospecha de alergia a las proteínas de la leche de vaca (APLV) en el niño, se recomienda priorizar la continuación de la lactancia materna. |
98 % 1era ronda |
|
VIH |
Declaración 49: La falta de una prueba de VIH negativa en el último trimestre en una madre sin factores de riesgo para infección, cuando las pruebas anteriores han sido negativas, no justifica postergar el inicio de la lactancia en la primera hora de vida, a la espera del resultado de la prueba realizada durante el parto. Es importante explicar y discutir los riesgos y beneficios con la familia antes de tomar una decisión. |
88 % 2da ronda Modificada en redacción y discusión |
|
Declaración 50: Una gestante que convive con VIH, con buena adherencia al tratamiento y títulos no detectables de carga viral, que desee iniciar lactancia materna, debe recibir información completa sobre los beneficios y los riesgos de la lactancia. La lactancia debe ser exclusiva y se debe realizar un seguimiento más estrecho por el programa de VIH, asegurando el consentimiento informado de la decisión conjunta. |
88 % 2da ronda Modificada en redacción y discusión |
|
|
Galactogogos |
Declaración 51: La certeza, la evidencia y la eficacia de los galactogogos sean naturales o farmacológicos, son limitados con respecto a la seguridad para la madre y/o el bebe, con el fin de aumentar el volumen de leche o influir en el peso de los niños. Por lo tanto se recomienda priorizar la identificación y corrección de la causa subyacente de la baja producción de leche antes de considerar su uso. |
100 % 1era ronda |
|
Declaración 52: El empleo de medicamentos galactogogos debe reservarse para situaciones excepcionales, como en casos de hipogalactia verdadera o en la inducción de la lactancia. Su prescripción debe ser exclusiva por parte de personal médico, considerando la relación costo-beneficio, el conocimiento de sus efectos secundarios y tras proporcionar asesoramiento en lactancia. |
100 % 1era ronda |
|
|
Salud Mental |
Declaración 53: Durante la gestación, el período posparto y a lo largo de toda la etapa de lactancia, es esencial que se realice una evaluación integral de las madres que tome en cuenta su estado psicoemocional, reconociendo su carácter dinámico y multifactorial. La intervención oportuna es fundamental, basándose en los riesgos detectados, para asegurar el bienestar de la díada y el éxito del proceso de lactancia. Para llevar a cabo esta evaluación de manera efectiva, se recomienda el uso de un instrumento de medición validado específicamente para este propósito. |
100 % 1era ronda |
JUSTIFICACIÓN DE LAS DECLARACIONES
Declaración 1
Es fundamental que todos los profesionales de la salud conozcan y apliquen el Código Internacional de Comercialización de Sucedáneos de la Leche Materna. Hacerlo asegura que se brinde una orientación clara y sin sesgos sobre la lactancia materna, lo cual permite a las familias tomar decisiones informadas respecto a la nutrición de sus hijos.
Declaración 2
Los profesionales de la salud deben dar a conocer a toda mujer embarazada sobre las ventajas de amamantar y brindar información sobre los riesgos de utilizar fórmula infantil.
Declaración 3
En caso de no existir contraindicación absoluta para la lactancia materna, si la madre manifiesta su intención de alimentar a su hijo con fórmula infantil, es responsabilidad del profesional de la salud proporcionar información adecuada sobre los riesgos asociados a esta práctica, para que la madre pueda tomar decisiones informadas y conscientes.
Justificación de las declaraciones 1, 2 y 3
El conocimiento y la difusión de información adecuada sobre la lactancia materna son esenciales para incrementar los índices de adherencia y su duración, teniendo en cuenta que las decisiones sobre la alimentación infantil están influenciadas por creencias culturales, prácticas familiares y las recomendaciones de los profesionales de la salud (5). Sin embargo, estas recomendaciones a menudo se ven comprometidas por las estrategias comerciales de los fabricantes de fórmulas infantiles, que generan conflictos de interés y afectan la imparcialidad de la información. Por ello, es crucial que los profesionales de salud conozcan y apliquen el Código Internacional de Comercialización de Sucedáneos de la Leche Materna para proteger a madres y bebés de estas influencias comerciales (3,4,12,13).
Según un informe de The Lancet (2023), las estrategias comerciales han incrementado el uso de fórmulas infantiles, a pesar de que los beneficios de la leche materna en composición, propiedades inmunológicas y resultados en salud y desarrollo son incomparables (5,12). Además, desafíos comunes como la percepción de producción insuficiente de leche y el temor a no alimentar correctamente a los bebés son a menudo subestimados. Se requiere apoyo adecuado para los profesionales de salud, con capacitación en consejería libre de conflictos de interés y herramientas para proporcionar educación imparcial, lo que contribuiría a crear entornos que favorezcan la lactancia y empoderen a las familias lactantes (12, 13).
Un estudio publicado en British Medical Journal (2023) encontró que las afirmaciones de salud y nutrición en las fórmulas infantiles son comunes, aunque a menudo sin respaldo científico sólido y con un alto riesgo de sesgo. Estas afirmaciones, prohibidas por regulaciones internacionales, siguen presentes en muchos países (14).
Durante el embarazo, la mayor interacción de las mujeres con los profesionales de salud ofrece una oportunidad crucial para recibir información objetiva y relevante sobre los beneficios de la lactancia materna frente a las fórmulas comerciales. Abordar preocupaciones y preparar a las madres para el proceso de lactancia fomenta decisiones informadas y mejora la experiencia, haciéndola más positiva y exitosa (2, 5,15,16).
Declaración 4
La identificación del tipo de pezón por parte del profesional de la salud es una práctica rutinaria, será válida, siempre y cuando no se emitan juicios de valor, como, por ejemplo, decir que no se puede alimentar correctamente debido a que el pezón es plano, entre otros comentarios similares. Es importante recordar que es el recién nacido quien, a través de la succión, facilitará el proceso de alimentación.
Justificación de la declaración 4
Una revisión sistemática de Cochrane concluye que no existen estudios controlados aleatorios que respalden la recomendación de realizar un examen prenatal de las mamas para promover la lactancia materna (17). Esta evaluación rutinaria del pezón es controversial, ya que, si no se explica adecuadamente a la madre, podría interferir en el proceso de lactancia. Además, la capacidad de amamantar no depende únicamente de la forma del pezón, sino de factores como la técnica de agarre del bebé y la producción de leche. Identificar el tipo de pezón puede sesgar tanto a la madre como a los profesionales de salud, por lo que la educación prenatal debe enfocarse en enseñar técnicas adecuadas de lactancia, ya que es la areola, no el pezón, la clave para amamantar exitosamente (1, 17).
Aunque un agarre correcto facilita la transferencia de calostro y leche, los pezones planos o invertidos pueden interferir en la lactancia, por lo que es crucial guiar a la madre en técnicas que faciliten el agarre del bebé (18). Se recomienda acompañarla con consultas de lactancia, lo que puede aumentar las tasas de inicio y mantenimiento de esta (2).
En el protocolo ABM Clinical Protocol #19: Breastfeeding Promotion in the Prenatal Setting, se recomienda observar el desarrollo y la anatomía de los senos para identificar cualquier factor que pueda indicar un alto riesgo de problemas con la lactancia, como pezones planos o invertidos. Además, se sugiere derivar a la mujer embarazada a un médico especializado en medicina de la lactancia o a un consultor en lactancia si es necesario. Es fundamental crear un entorno empático, tener en cuenta los aspectos culturales y evitar emitir juicios de valor que puedan interferir con el éxito de la lactancia (1, 17).
Declaración 5
La extracción prenatal de calostro a partir de la semana 36 de gestación puede resultar de ayuda para aquellas mujeres que presentan riesgo de retraso en la lactogénesis II.
Justificación de la declaración 5
La extracción de calostro durante el embarazo puede estimular la producción de prolactina, lo que resulta especialmente beneficioso para mujeres con condiciones que afectan la lactogénesis II, como la diabetes. Esta práctica también proporciona un suministro inicial de leche materna para el bebé en caso de que surjan dificultades para amamantar inmediatamente después del parto, lo cual puede ocurrir en situaciones de partos prematuros o complicaciones tanto maternas como neonatales. Para garantizar la seguridad y efectividad de esta práctica, es fundamental que sea supervisada por un profesional de salud, quien también debe ofrecer orientación sobre el almacenamiento y uso adecuado del calostro extraído (1,19,20,21).
A pesar de la falta de evidencia sólida de alta calidad sobre los efectos de la extracción prenatal de calostro en los resultados maternos y neonatales, diversos estudios han aportado información valiosa. El ensayo DAME, que es el estudio más grande realizado hasta la fecha sobre esta práctica, demostró que la extracción prenatal es segura para mujeres con diabetes gestacional o preexistente, sin que se observe un impacto negativo en la edad gestacional del parto ni en las tasas de admisión a la unidad de cuidados intensivos neonatales. Además, no se asoció con riesgos como la hiperestimulación uterina o el compromiso fetal. Este estudio también reveló que la extracción prenatal de calostro aumentó las tasas de lactancia exclusiva a los 3 meses de edad y redujo el uso de fórmula láctea durante la estancia hospitalaria del grupo intervenido (19).
En otro estudio piloto, aleatorizado y controlado, que incluyó a mujeres nulíparas no diabéticas de bajo riesgo entre las semanas 34 y 36 de gestación, no se encontró evidencia de que la extracción prenatal estuviera relacionada con resultados adversos en términos de seguridad. Los efectos secundarios más comunes reportados fueron contracciones uterinas transitorias y un aumento en la actividad fetal durante o inmediatamente después de la extracción. Este estudio concluyó que no existen riesgos significativos asociados con la extracción prenatal de calostro y que, en varios casos, proporcionó un suministro de respaldo de leche materna, lo que probablemente redujo el uso de la fórmula infantil (20).
Sin embargo, se ha señalado la falta de evidencia sobre la seguridad de esta práctica en embarazos múltiples. Por lo tanto, no se puede realizar una recomendación en estos casos, limitando su aplicación a embarazos únicos.
Declaración 6
Las cirugías de las mamas como mamoplastia de aumento o reducción y mastectomía parcial no representan contraindicación para la lactancia materna exclusiva.
Justificación de la declaración 6
Una revisión sistemática y metanálisis, que incluyó 11 estudios, concluyó que 8197 de 9965 pacientes (82.25%) fueron capaces de amamantar con éxito después de someterse a implantes mamarios (22). Aunque la mamoplastia de aumento no mostró diferencias significativas en la experiencia inicial de lactancia, las mujeres que pasaron por este procedimiento presentaron tasas más bajas de lactancia materna al alta hospitalaria (79% frente a 89%) y de lactancia exclusiva al mes después del parto (54% frente a 80%). Por otro lado, la mamoplastia de reducción presenta mayores desafíos para la lactancia, con estudios que evidencian una interrupción temprana y una menor disposición a continuar la lactancia exclusiva a los 4 meses. El éxito de la lactancia tras una reducción depende de la preservación del parénquima subareolar, con una tasa de solo 4% cuando no se conserva (23).
Varios estudios han demostrado que las cirugías mamarias no afectan la capacidad de producir leche materna. Sin embargo, pueden reducir la sensibilidad del pezón y dificultar el agarre del bebé, pero con el apoyo adecuado de especialistas en lactancia y el uso de técnicas correctas, es posible superar estos obstáculos (22). En resumen, no existe una contraindicación absoluta para la lactancia materna en mujeres con cirugías mamarias; con el apoyo correcto, se puede lograr una lactancia exitosa (24).
Declaración 7
No se recomienda suspender la lactancia durante una nueva gestación excepto en amenaza de aborto o amenaza de parto pretérmino.
Declaración 8
Practicar el amamantamiento de manera simultánea a dos niños de diferentes edades es una práctica segura que no implica riesgos nutricionales ni de salud tanto para la madre como para los lactantes.
Justificación de las declaraciones 7 y 8
Una revisión sistemática y metaanálisis concluyó que la lactancia durante el embarazo no genera efectos adversos ni para la madre ni para el feto. Se recomienda que, para beneficio de ambos, las mujeres embarazadas continúen amamantando si así lo desean, siempre y cuando mantengan un régimen nutricional adecuado (25). No obstante, se sugiere un análisis más profundo y riguroso para obtener conclusiones más sólidas y adaptar las recomendaciones a cada caso individual.
Las principales razones para el destete iniciado por las madres durante una nueva gestación fueron el dolor y la sensibilidad en los senos y pezones. En estos casos, es crucial proporcionar apoyo tanto a la madre como al bebé o niño pequeño que es destetado (2).
Amamantar simultáneamente a dos niños de diferentes edades se considera una práctica segura. No se observaron diferencias significativas entre la lactancia en tándem y la lactancia individual en términos de volumen de leche, grasa total, carga microbiana, composición metabólica y metataxonómica. La leche de madres que amamantan en tándem no mostró variabilidad diurna en sus componentes, lo que sugiere un papel adaptativo de la leche humana para cubrir las necesidades nutricionales tanto de recién nacidos como de niños mayores, incluso menores de 6 meses. Estos resultados apoyan la promoción de la lactancia continuada, incluyendo la lactancia en tándem (26, 27). En cuanto al volumen de leche, la producción se ajusta a la demanda. Si la madre está amamantando a dos o más niños, ya sean recién nacidos o mayores, producirá más leche para satisfacer sus necesidades (2). Los expertos que colaboraron en el consenso, basándose en la revisión de la literatura y su experiencia clínica, apoyan la continuidad de la lactancia durante una nueva gestación y en tándem (28).
Declaración 9
En los bebés sanos la lactancia humana debe darse a libre demanda, lo que implica ofrecer el pecho tantas veces y durante el tiempo que el bebé desee.
Declaración 10
Se aconseja que un recién nacido sea amamantado al menos 8 veces en el transcurso de 24 horas.
Declaración 11
No existe una duración fija para las tomas de leche materna del recién nacido, por lo que se deben valorar los signos de saciedad y satisfacción para determinar la duración adecuada.
Declaración 12
Es fundamental que el profesional de la salud pueda reconocer y evaluar de manera efectiva las señales que indican una adecuada transferencia de leche materna durante la lactancia, tales como la presencia de series repetidas de succiones profundas, rítmicas y coordinadas, con intervalos de pausa y evidencia de deglución, que puede ser audible o no, especialmente en recién nacidos.
Justificación declaraciones 9 a 12
La lactancia materna a libre demanda es un proceso natural en el que la madre amamanta a su bebé cada vez que este lo requiere, sin restricciones de tiempo ni frecuencia. Es fundamental que los profesionales de la salud desempeñen un papel activo en fortalecer la confianza de la madre en su capacidad para alimentar a su hijo. Esto implica apoyar el proceso de libre demanda como una forma de establecer una comunicación asertiva, ayudando a la madre a identificar correctamente las señales de hambre y saciedad del bebé, y asegurando que pueda brindarle el alimento necesario de manera oportuna (5).
Las señales de hambre incluyen llevarse las manos a la boca, chuparse los labios, emitir sonidos, buscar, mover los ojos durante el sueño ligero y agitar las extremidades antes de empezar a llorar que debe considerarse como una señal tardía. Es importante que el profesional conozca y enseñe a la madre cómo responder a estas señales, en lugar de intentar amamantar según un horario rígido. Se recomienda que los recién nacidos sean puestos al pecho con frecuencia y siempre que muestren dichas señales, lo cual estimula la producción de leche (2).
La lactancia materna debe continuar en cada pecho sin límite de tiempo, observando los signos de saciedad que incluyen el cese de la succión vigorosa, el desprendimiento espontáneo del pecho, una apariencia relajada y somnolencia tras la alimentación. Un bebé satisfecho no mostrará interés en volver al pecho si es separado suavemente. (29, 30, 31).
A partir del segundo día de vida, el recién nacido debería estar más alerta y querer mamar con mayor frecuencia, normalmente de 8 a 12 veces o más en 24 horas. La alimentación en racimos, que suele comenzar en la segunda noche, se caracteriza por una lactancia casi constante durante varias horas. Este comportamiento es normal y no debería generar preocupación por una ingesta insuficiente de leche, a menos que se observen otros signos de ingesta inadecuada (2).
La observación de recién nacidos lactantes sanos ha demostrado que suelen realizar al menos ocho tomas en un período de 24 horas. Algunos pueden alimentarse cada dos o tres horas, tanto de día como de noche, mientras que otros optan por tomas consecutivas durante varias horas y luego descansan. Además, muestran señales de hambre al menos ocho veces al día (29, 31).
El volumen de leche que una madre extrae no siempre refleja con exactitud la cantidad transferida al bebé, ya que también depende de la capacidad del bebé para succionar. Los aspectos clave para evaluar una correcta transferencia de leche incluyen una succión rítmica y audible, un buen agarre del pecho donde la boca del bebé cubra gran parte de la areola, y la sensación de alivio en el pecho de la madre después de la toma. El bebé debe soltar el pecho de manera espontánea al final de la alimentación, lo que indica satisfacción. Además, el número de pañales con diuresis y deposiciones es un indicador importante: en el primer día, el bebé debería mojar un pañal y tener una evacuación de meconio; hacia el cuarto día, se esperan cuatro pañales mojados y deposiciones más claras. A partir del quinto día, un bebé amamantado debe mojar al menos cinco pañales diarios y tener alrededor de tres evacuaciones amarillas, lo que sugiere una adecuada ingesta y transferencia de leche. (31,32).
Declaración 13
En el caso de lactantes sanos a término, se espera que durante el primer día de vida la ingesta promedio de calostro por toma oscile entre 2 y 10 ml, aumentando a medida que pasan los días. Por ello, es importante que las expectativas sobre la producción de leche materna tomen en cuenta este aspecto.
Justificación declaración 13
La cantidad y la composición de la leche materna experimentan cambios a lo largo del tiempo y están influenciadas por diversos factores tanto maternos como relacionados con el lactante. La producción diaria estimada de leche se representa en la tabla 2, es importante señalar que es común observar volúmenes de leche relativamente bajos por toma durante las primeras 24 a 48 horas, una situación normal que, sin embargo, suele generar preocupación tanto en madres como en profesionales. Es crucial destacar que esta disminución inicial no necesariamente justifica la suplementación y suele resolverse de manera natural (32,33). Tabla 2.
Tabla 2. Ingesta promedio reportada de calostro por bebés sanos amamantados a término
|
Tiempo (horas) |
Ingesta (mL/toma) |
|
Primeras 24 |
2–10 |
|
24–48 |
5–15 |
|
48–72 |
15–30 |
|
72–96 |
30–60 |
Adaptado de referencias 31, 32.
Declaración 14
Se debe valorar la eficacia de la lactancia materna en la primera hora de vida del recién nacido y posteriormente una vez en el periodo de alojamiento conjunto, en las horas previas al alta hospitalaria de la madre y el bebé.
Declaración 15
La valoración de la lactancia y efectividad de la toma, debe ser realizada por un profesional con formación en consejería en lactancia materna.
Declaración 16
En la valoración ambulatoria del recién nacido, que se realiza entre el tercer y quinto día de vida, se debe evaluar la técnica de lactancia materna y su efectividad, por un profesional con formación en consejería en lactancia materna.
Declaración 17
Previo al alta hospitalaria, es importante que se realice una evaluación completa de la lactancia materna, que debe quedar registrada en la historia clínica del recién nacido. Dicha evaluación debe incluir, como mínimo, una lista de verificación que contemple la evaluación de la posición de la madre y del bebé durante el amamantamiento, la valoración del agarre del lactante para succionar adecuadamente, la evaluación de la transferencia de leche materna, la observación de la presencia de meconio y orina en el recién nacido.
Declaración 18
Previo al alta hospitalaria, la valoración de la lactancia debe incluir un instrumento que permita evaluar la autoeficacia en la madre.
Justificación declaraciones 14 a 18
El contacto piel a piel inmediato e ininterrumpido y el inicio de la lactancia materna la primera hora de vida, llamada también la hora de oro de la lactancia, se han correlacionado como facilitadores de una lactancia materna exclusiva (2,5). El contacto piel a piel del binomio tras el parto ha demostrado la aparición de conductas instintivas para el inicio de la lactancia, favorece la regulación de temperatura, frecuencia cardiaca y glicemia, disminuye niveles de cortisol tanto en la madre como en el recién nacido, esto hace parte de la política de IAMII (Instituciones Amigas de la Mujer y la Infancia Integral (34) y políticas en salud como la resolución 3280 de 2018 (35) y ley de parto humanizado (ley 2244 de 2022) (36).
La evaluación completa de la lactancia materna debe iniciarse tras el nacimiento y las veces que sean necesarias durante su estancia institucional y al egreso, al menos entre el 3er y 5to día de vida como se muestra en la tabla 3 (35). Dicha evaluación debe realizarse por un profesional de la salud con formación en consejería en lactancia, para ello es crucial proporcionar educación sobre lactancia materna a los profesionales de la salud que atienden a mujeres y niños e idealmente garantizar el acceso a especialistas en lactancia, como aquellos acreditados como Consultores en Lactancia Certificados por la Junta Internacional (IBCLC) o miembros de la Academia de Medicina de Lactancia Materna (FABM) (2).
Tabla 3 Evaluación de la lactancia. (Adaptado de Ref 32, 37)
Tabla 3. Evaluación de la lactancia
|
Tiempo para la observación y evaluación de la efectividad de la lactancia |
|
|
Alojamiento conjunto |
Al alta hospitalaria |
|
· Al menos una vez cada 8–12 horas durante la hospitalización.
·Al menos una vez dentro de las 8 horas previas al alta hospitalaria.
|
Dentro de las 48 a 72 horas del alta hospitalaria para madre-hijo con: · Gestación menor a 37 semanas. · Cualquier factor de riesgo para dificultades en la lactancia. · Madres que experimentan dolor durante la lactancia. · Bebés con pérdida de peso mayor de lo esperado. · Bebés menores de 48 horas al momento del alta. · Bebés con factores de riesgo para hiperbilirrubinemia
Al 3er 5to dia del alta para todos los demás bebés amamantados sin factores de riesgo. |
Adaptado de Ref 35, 37
Existen herramientas útiles para la evaluación de la lactancia, como la escala de LATCH (2), que evalúa la eficacia del amamantamiento observando cinco aspectos clave: agarre del bebé al pecho, audibilidad de la deglución, tipo de pezón, nivel de comodidad de la madre y el apoyo que el bebé requiere para su posición.
La percepción de la autoeficacia en la lactancia está influenciada por diversos factores, como las experiencias previas y del entorno, así como su estado fisiológico y emocional. Medir la autoeficacia en la lactancia permite identificar las mujeres que están en riesgo de un abandono precoz de la misma (38,39). Existen varias escalas que permiten identificar dicha percepción de las madres frente a la lactancia, la escala de autoeficacia BSES-SF (Breastfeeding Self Efficcacy- Short Form, por sus siglas en inglés) (38,39) es una de las más usadas y ha sido validada en distintas poblaciones y recientemente para Colombia (40). Estudios epidemiológicos han evaluado la relación entre la confianza de la madre para amamantar y los factores sociodemográficos, clínicos y emocionales. Las mujeres que tenían mayor puntuación en la escala BSES-SF a la semana 1 post parto, tenían más probabilidad que siguieran amamantando a la semana 4 y 8 postparto y dicha puntuación también se ha asociado con una mayor probabilidad de lactancia materna exclusiva en los primeros seis meses (39,41)
Esta escala identifica madres lactantes en alto riesgo, para individualizar las estrategias de fomento de la confianza, y así evaluar la eficacia de diversas intervenciones y guiar el desarrollo de programas (38,39,40).
Declaración 19
Previo al alta hospitalaria, es importante proporcionar a la madre entrenamiento para realizar la extracción de leche materna de manera manual y su almacenamiento con seguridad y eficacia.
Justificación de la Declaración 19
Es fundamental que, antes del alta hospitalaria, todas las madres lactantes reciban instrucciones sobre la técnica de extracción manual de leche, incluso si utilizan un extractor. Este entrenamiento permite aliviar la congestión mamaria, aumentar y mantener la producción de leche, así como disponer de leche materna para alimentar al lactante en caso de separación o si el bebé no puede alimentarse directamente del pecho, también contribuye a evitar el dolor causado por congestión mamaria, a preparar papillas para la alimentación complementaria y ofrece la opción de donar la leche a bancos de leche humana (42,43,44).
No se recomienda usar la extracción con el objetivo de cuantificar la producción láctea, ya que puede llevar a la madre a pensar erróneamente que no produce suficiente leche. Es importante considerar que el bebé, al succionar directamente del pecho, extrae una cantidad mayor que la obtenida por medios de extracción.
Se recomienda brindar información adicional sobre el manejo de la extracción y conservación de la leche (44,45). Esta información, idealmente proporcionada por escrito, debe incluir las normativas establecidas en la legislación nacional, como la Resolución 3280 de 2018, que contempla la Ruta Integral de Salud para la población materno perinatal (35,46).
Declaración 20
No se debe proporcionar a los recién nacidos en alojamiento conjunto ningún alimento o líquido oral que no sea leche materna, sin previa valoración de la efectividad de la lactancia por profesional experto.
Declaración 21
En caso de ser necesaria la suplementación, la primera opción para alimentar a un bebé que no logra el aporte mediante succión directa del pecho, debe ser la administración de leche humana extraída.
Justificación declaraciones 20 y 21
Existen situaciones clínicas comunes en las que es necesario evaluar y tratar la lactancia materna sin recurrir a suplementos. Es fundamental prestar atención a las señales de hambre del bebé y fomentar el contacto piel con piel, lo que promueve una alimentación frecuente y adecuada. Este comportamiento de alimentación en el recién nacido es normal, y es crucial asegurar un agarre correcto, así como tratar cualquier dolor que experimente la madre. Aunque el cansancio materno es algo habitual, no debe llevar a la separación del binomio madre-hijo, ya que esto podría afectar la exclusividad de la lactancia. Una gestión efectiva de la lactancia puede contribuir tanto a la satisfacción del lactante como a que la madre pueda descansar adecuadamente (33).
Se debe realizar una valoración de la efectividad de la lactancia por profesional experto, antes de considerar suplementar a un recién nacido. Un análisis sistemático de recién nacidos sanos, a término y amamantados no mostró beneficios de la suplementación rutinaria con alimentos o líquidos en el periodo posparto temprano. La introducción temprana de fórmula suplementaria se asocia con un riesgo más de dos veces mayor de cese temprano de la lactancia materna, incluso al controlar variables de confusión (33,47).
La alimentación con fórmula infantil, ya sea como suplemento o en forma exclusiva, se asocia con un rápido aumento de peso. Esta trayectoria no fisiológica de aumento de peso está vinculada a la obesidad infantil. En un estudio de cohorte prospectivo con más de 300 recién nacidos, una ganancia de peso superior a 100 gramos durante la primera semana después del nacimiento se asoció con sobrepeso a los 2 años de edad (32, 48).
Debido a que continúa acumulándose evidencia sobre los riesgos importantes de la suplementación en los primeros días después del nacimiento, el uso prudente de esta es un objetivo crítico, con un retorno a la exclusividad siempre que sea posible. Si se indica la suplementación, las opciones en orden de preferencia son: 1) leche extraída de la propia madre del bebé, 2) leche humana donada pasteurizada y 3) fórmulas infantiles. Los posibles riesgos y beneficios de estas opciones deben considerarse en el contexto de la edad del bebé, el volumen requerido y el impacto en el establecimiento de la lactancia materna y deben ser informados a los padres (3, 32, 33, 49).
Declaración 22
Se recomienda evitar el uso del chupo de biberón o chupo de entretención al menos el primer mes de vida, y hasta que la lactancia materna esté consolidada.
Declaración 23
Se desaconseja el uso de pezoneras de forma rutinaria para disminuir dolor, por tipo de pezón, o con la intención de mejorar el agarre, en su lugar se requiere una evaluación e intervención desde la adecuada consejería en lactancia.
Declaración 24
No existe evidencia concluyente que demuestre indicaciones claras, efectividad y seguridad del uso de las pezoneras. Por lo tanto, el profesional de la salud debe tener precaución al recomendar este accesorio, utilizándolo como última opción y solo cuando se haya constatado que el agarre sigue siendo inadecuado después de una intervención en lactancia.
Declaración 25
El empleo de pezoneras debe ser temporal, ya que puede disminuir la transferencia de leche y, por ende, comprometer la nutrición del recién nacido. Además, se requiere una estrecha monitorización durante su utilización.
Justificación declaraciones 22 a 25
Para iniciar y mantener la lactancia materna, tanto la OMS como UNICEF, en el paso 9 de la Iniciativa Hospital Amigo del Niño (IHAN) (50), y en el paso 6 de la estrategia IAMII (34), recomiendan no ofrecer chupos de biberón o de entretención a los bebés amamantados. Esto se debe a que pueden interferir con la lactancia al generar confusión y reducir la frecuencia con la que el niño succiona el pecho.
La Academia Americana de Pediatría (AAP) coincide en gran medida con la iniciativa IHAN; sin embargo, no apoya una prohibición categórica del uso de chupos debido a su rol en la reducción del riesgo de Síndrome de Muerte Súbita del Lactante (SMSL) y sus beneficios analgésicos durante procedimientos dolorosos cuando la lactancia materna no puede ofrecer este alivio (5). La evidencia sugiere que el uso de chupos no afecta la duración de la lactancia, aunque su impacto se centra principalmente en la instauración inicial de la misma (51). Por lo tanto, se recomienda retrasar la introducción del chupo hasta que la lactancia materna esté firmemente establecida.
El uso de chupos puede enmascarar las primeras señales de hambre del bebé, lo que podría llevar a la pérdida de tomas y afectar la ingesta adecuada de leche. Evitar su uso y maximizar las oportunidades de amamantar ayudará a establecer una lactancia efectiva (2, 31).
En cuanto a los recién nacidos prematuros tardíos, existe evidencia de que algunos son más susceptibles a problemas de alimentación cuando se suplementan con biberón. En términos generales, se considera que evitar el uso de biberones y chupos contribuye a una lactancia materna exitosa (32).
El uso de pezoneras de silicona al inicio de la lactancia aumenta en 1.4 veces la probabilidad de interrumpir la lactancia exclusiva antes de los 4 meses, y en 3.4 veces si se usa durante todo el periodo de lactancia como se evidenció en un estudio de cohorte con el objetivo de investigar la asociación entre el uso de pezoneras de silicona al inicio de la lactancia y la interrupción de la misma durante los primeros 6 meses de vida del lactante (52).
Se ha informado que el uso de pezoneras también afecta negativamente las tasas de lactancia exclusiva en bebés prematuros al ser dados de alta. El uso de pezoneras incrementó en 2.3 veces la probabilidad de fracaso en la lactancia exclusiva al alta. Además, se ha observado que las mujeres que usaron pezoneras de silicona al inicio de la lactancia interrumpieron la lactancia exclusiva 2.5 meses antes que aquellas que no las usaron. Cuando se comparan las curvas de supervivencia para la lactancia materna exclusiva durante los primeros 6 meses de vida, según el uso de pezoneras de silicona al inicio de la lactancia, se observaron claras diferencias, especialmente en los primeros 3 meses de vida. La probabilidad de interrupción de la lactancia exclusiva entre las mujeres que usaron pezoneras fue inversamente proporcional a la edad del lactante y fue el doble en el primer mes (52).
Existen varias hipótesis que podrían explicar esta asociación. Una de ellas es la posibilidad de una menor transferencia de leche al bebé debido al uso de la pezonera. Un estudio en Australia reportó una reducción del 25% en el volumen de leche extraída cuando se usaban pezoneras de silicona. Menor transferencia de leche podría reducir la oferta, aumentando las posibilidades de recurrir a fórmulas infantiles. Otra hipótesis es que el uso de pezoneras sea un indicador de dificultades en la lactancia, las cuales se sabe que son una causa importante de la interrupción de la lactancia exclusiva (53).
Un hallazgo notable fue que el uso de pezoneras fue más frecuente en clínicas privadas (25.8%) que en públicas (6.2%). Este alto porcentaje en el sector privado es preocupante, especialmente para recién nacidos a término y sanos, lo que sugiere un uso excesivo de este aditamento (52).
La literatura sugiere que se debe tener cautela al recomendar el uso de pezoneras, ya que podrían aumentar el riesgo de interrupción de la lactancia exclusiva. Se necesitan más estudios para investigar las indicaciones, la duración recomendada del uso y el seguimiento necesario por parte de los profesionales de salud. (54, 55).
Las pezoneras no constituyen una solución efectiva para el dolor o las dificultades con el agarre. Su uso, además de reducir la transferencia de leche, puede agravar los problemas de lactancia, lo que puede llevar a las madres a perder confianza en su capacidad para amamantar. Por lo tanto, se desaconseja el uso rutinario de pezoneras y se enfatiza en la necesidad de una evaluación y consejería adecuada en lugar de recurrir a soluciones rápidas (55, 56). Si, tras una evaluación individualizada, se decide utilizar este accesorio, debe hacerse de manera temporal y bajo un seguimiento estricto.
Declaración 26
Un frenillo sublingual no siempre interfiere con el amamantamiento y solo si se evidencia anquiloglosia, se requiere una intervención desde terapia con fonoaudiología hasta frenotomía de acuerdo a lo requerido en cada caso.
Justificación declaración 26
Como el frenillo es un diagnóstico funcional, la presencia de un frenillo sublingual por sí solo, una estructura anatómica común y normal, no es una indicación de intervención quirúrgica, la anquiloglosia es una anomalía oral congénita en los recién nacidos, lo que puede provocar dificultades para succionar y provocar dolor en los pezones, bajo suministro de leche, poco aumento de peso, fatiga materna y frustración. El manejo conservador de los problemas de lactancia materna puede ser efectivo con el apoyo adecuado, modificando el agarre y la posición del bebé, es necesario que la familia tenga acceso al seguimiento en un entorno multidisciplinario (fonoaudiología, odontopediatría, consultor en lactancia) donde se pueda evaluar la lactancia materna y realizar una frenotomía si está indicada en el futuro (2, 57, 58, 59).
Declaración 27
Un porcentaje de pérdida de peso mayor al 7% después del segundo día de vida, puede sugerir dificultad en el proceso de amamantamiento y requiere evaluación cuidadosa del recién nacido e intervención en la lactancia.
Declaración 28
La principal intervención en los recién nacidos amamantados y con pérdida de peso superior al 7% entre el 3er y 5to día de vida es la evaluación integral del amamantamiento y se debe implementar corrección de las dificultades identificadas.
Declaración 29
Si se detecta una pérdida de peso superior al 7% entre el tercer y quinto día de vida, es necesario realizar un seguimiento entre 48 y 72 horas después de intervenir en la lactancia.
Declaración 30
En un recién nacido amamantado de manera exclusiva, la pérdida de peso mayor al 7 - 10% sin signos de deshidratación o ictericia no necesariamente es motivo de hospitalización y separación del binomio madre-hijo, requiere intervención en la lactancia.
Declaración 31
La recuperación del peso al nacer en un recién nacido amamantado de manera exclusiva y a libre demanda, debe darse entre los 10 a 21 días de vida.
Declaración 32
Si un recién nacido amamantado de manera exclusiva y a libre demanda no logra la recuperación del peso al nacer entre los 10 a 21 días de vida, se requiere realizar una evaluación exhaustiva de la lactancia y descartar patología mamaria o propia del recién nacido y no necesariamente es indicación de suplementación con fórmula.
Declaración 33
La deshidratación hipernatrémica del recién nacido asociada a lactancia materna exclusiva, se puede prevenir educando a las madres sobre las técnicas de lactancia materna desde el período prenatal y en la estancia hospitalaria tras el parto.
Justificación a las declaraciones 27 a 33
La pérdida de peso fisiológica es común en los recién nacidos sanos después del parto, en el caso de los bebés alimentados exclusivamente con leche materna, suele estabilizarse al transitar de la lactogénesis I a la lactogénesis II. Un recién nacido a término tiene un peso compuesto en un 75% por agua, en comparación con el 60% en adultos. Durante los primeros días después del nacimiento, la producción de orina es baja, seguida de una diuresis fisiológica que puede conllevar una pérdida de hasta el 7% al 10% del peso al nacer. La producción y/o transferencia insuficiente de leche en bebés amamantados exclusivamente puede contribuir a una pérdida excesiva de peso en los primeros días de vida, por lo que siempre debe evaluarse en el contexto del estado clínico del bebé. (32, 60, 61). La evaluación debe realizarse por parte de un equipo multidisciplinario que garantice una atención integral y un seguimiento cercano.
Se han desarrollado nomogramas para el peso de los recién nacidos basados en datos de más de 100,000 bebés sanos alimentados exclusivamente con leche materna. La trayectoria de la pérdida de peso en el tiempo, junto con la información clínica, proporciona un contexto sólido para la toma de decisiones basada en evidencia (60, 62). Una pérdida de peso que se sitúa en el percentil 75 de estos nomogramas requiere una evaluación exhaustiva. Además, los pesos de los lactantes individualmente pueden graficarse en relación con estos nomogramas utilizando la Herramienta de Peso Temprano del Recién Nacido recomendada por la AAP (NEWT) (https://www.newbornweight.org) (32, 63).
Entre los factores que influyen en el porcentaje de pérdida de peso al nacer y en la velocidad de recuperación se encuentran la edad materna, el índice de masa corporal, el tipo de parto, las soluciones intravenosas administradas durante el parto, el número de embarazos previos, el sexo del recién nacido, la edad gestacional y la eliminación de meconio. (60, 61, 64, 65, 66).
Es importante destacar que una pérdida de peso superior al 10% del peso al nacer en los primeros días de vida, sin signos de deshidratación o ictericia no indica la necesidad de suplementación artificial. La deshidratación hipernatrémica del recién nacido asociada a lactancia materna exclusiva, se puede prevenir educando a las madres sobre las técnicas de lactancia materna desde el período prenatal y en la estancia hospitalaria tras el parto, conociendo los factores de riesgo para deshidratación hipernatrémica como; parto por cesárea, primiparidad, anomalías mamarias, problemas con la lactancia, peso materno elevado antes del embarazo, inicio tardío de la lactancia, falta de experiencia previa en lactancia materna y bajo nivel educativo de la madre (67, 68, 69). La decisión de suplementar debe ser individualizada, teniendo en cuenta todos los factores mencionados y siempre favoreciendo la lactancia materna, considerando como primera opción suplementación con leche materna extraída. (32, 33). La intervención más adecuada consiste en revisar y corregir la técnica de amamantamiento y evaluar la lactancia. Se requiere un control estricto entre 48 y 72 horas para evaluar la efectividad de la intervención. Basar las decisiones clínicas únicamente en el porcentaje de peso perdido al final de la primera semana de vida es una práctica arbitraria sin evidencia científica consistente, lo que puede llevar a una suplementación innecesaria y reducir las posibilidades de que el recién nacido sea alimentado exclusivamente con leche materna los primeros 6 meses de vida. (64).
En cuanto al tiempo requerido para la recuperación del peso al nacer, la Guía NICE No. 75 indica que un periodo entre 14 y 21 días, respaldado por la evidencia, es una estimación adecuada para que el recién nacido amamantado exclusivamente recupere su peso. Es fundamental que tanto los padres como los profesionales de la salud estén informados sobre este plazo estimado. (66).
Declaración 34
La toma de glucometría no se debe realizar de manera rutinaria en recién nacidos sanos, excepto en aquellos con riesgo de hipoglucemia como: pretérmino tardío, a término pequeño para la edad gestacional, hijos de madre diabética o grandes para la edad gestacional.
Declaración 35
Los lactantes con factores de riesgo para hipoglucemia como: pretérmino tardío, a término pequeño para la edad gestacional, hijos de madre diabética o grandes para la edad gestacional, que se encuentren asintomáticos deben continuar siendo amamantados con la recomendación de alimentar a libre demanda o cada 2 a 3 horas las primeras 24 a 72 horas de vida.
Declaración 36
Los lactantes con factores de riesgo para hipoglucemia como: pretérmino tardío, a término pequeño para la edad gestacional, hijos de madre diabética o grandes para la edad gestacional, que se encuentren asintomáticos no requieren suplementación de rutina con líquidos dextrosados o fórmula infantil.
Declaración 37
En los lactantes con factores de riesgo para hipoglucemia como: pretérmino tardío, a término pequeño para la edad gestacional, hijos de madre diabética o grandes para la edad gestacional; se debe verificar la técnica de amamantamiento y adecuada transferencia de leche antes del alta hospitalaria, dejar claras las señales de alarma y garantizar el control en las primeras 48 a 72 horas.
Justificación a las declaraciones 34 a 37
Durante el tercer trimestre, el feto almacena glucógeno, produce catecolaminas y acumula grasa parda para satisfacer sus necesidades energéticas al nacer. Los recién nacidos sanos utilizan estas reservas para mantener la termorregulación y satisfacer sus requerimientos metabólicos, principalmente a través del metabolismo de la grasa parda y la liberación de hormonas contrarreguladoras como el glucagón, la epinefrina, el cortisol y la hormona del crecimiento, que movilizan glucosa y combustibles alternativos. (70, 71).
En los primeros días de vida, la ingesta oral no es la principal fuente de energía para los neonatos sanos nacidos a término. El calostro, con un contenido energético de 16 kcal/oz, es suficiente para cubrir las demandas metabólicas. A medida que las reservas de glucógeno se agotan, los recién nacidos dependen de la alimentación enteral, obteniendo aproximadamente la mitad de su energía de grasas. (32).
Tras el nacimiento, los niveles de glucosa en los neonatos alcanzan un mínimo en las primeras horas y luego se normalizan. Los neonatos sanos compensan niveles bajos de glucosa disminuyendo la producción de insulina y aumentando la gluconeogénesis y la producción de cetonas. Por lo tanto solo se recomienda monitorizar la glucosa en lactantes con factores de riesgo ˆy en aquellos con síntomas de hipoglucemia. (71, 72).
El manejo de la hipoglucemia neonatal debe considerar las necesidades metabólicas y fisiológicas de cada recién nacido, sin interrumpir innecesariamente la lactancia materna ni la relación madre-hijo. La lactancia materna temprana y exclusiva es clave para satisfacer las necesidades nutricionales de los recién nacidos sanos, por lo que debe iniciarse dentro de los primeros 30 a 60 minutos después del nacimiento, incluso en bebés en riesgo de hipoglucemia. El contacto piel a piel entre madre e hijo favorece el inicio de la lactancia, mantiene la temperatura corporal del bebé y reduce el gasto energético, ayudando a estabilizar los niveles de glucosa en sangre. (32).
La evidencia sugiere que la monitorización de la glucosa en recién nacidos sanos no es necesaria de forma rutinaria, ya que la mayoría de estos bebés no presentarán hipoglucemia. Según las recomendaciones de la AAP, ABM, solo se deben monitorear aquellos que pertenecen a grupos de riesgo específicos, como los bebés pretérmino tardío, los que son pequeños para su edad gestacional, los hijo de madres diabéticas y los que son grandes para su edad gestacional. Esto se debe a que estos grupos tienen una mayor probabilidad de presentar desequilibrios metabólicos, como hipoglucemia, que pueden requerir intervención. Además, la monitorización innecesaria puede resultar en tratamientos inadecuados y ansiedad tanto para los padres como para el personal médico (32, 70, 71).
La lactancia materna temprana es fundamental para la estabilización de los niveles de glucosa en recién nacidos en riesgo. Amamantar cada 2 a 3 horas asegura que el bebé reciba la nutrición necesaria para satisfacer sus demandas metabólicas y contribuye a la adecuada transferencia de calostro. Se debe fomentar la alimentación temprana con leche materna o extraída en bebés con factores de riesgo para hipoglucemia. La administración rutinaria de suplementos dextrosados o fórmula infantil en neonatos asintomáticos con factores de riesgo para hipoglucemia puede resultar innecesaria y, en efecto, puede obstaculizar el establecimiento de la lactancia materna (33, 71). Por lo tanto, la atención en recién nacidos sanos asintomáticos con factores de riesgo debe centrarse en verificar la técnica de amamantamiento y asegurar una adecuada transferencia de leche antes de considerar cualquier intervención adicional (71).
Un monitoreo riguroso antes del alta hospitalaria es fundamental para identificar y corregir posibles problemas de lactancia. Además, es crucial educar a los padres sobre las señales de alarma, como la letargia o la falta de alimentación, y garantizar un control clínico temprano entre las 48 y 72 horas posteriores al alta. Este período es crítico, ya que los lactantes son particularmente vulnerables a la hipoglucemia, especialmente aquellos que presentan factores de riesgo (32, 71).
Declaración 38
Con el inicio e instauración de la alimentación complementaria, la leche materna se debe continuar ofreciendo a libre demanda (Sin horarios ni tiempos establecidos de duración).
Declaración 39
La lactancia materna debe mantenerse y protegerse como un alimento óptimo y ofrecerse a libre demanda en cualquier edad, independientemente del estado nutricional del niño, incluyendo situaciones de malnutrición como bajo peso, desnutrición, sobrepeso u obesidad; siguiendo con el tratamiento y seguimiento correspondiente a su condición individual.
Justificación de las declaraciones 38 y 39
La leche materna cubre las necesidades nutricionales de los niños menores de seis meses sin requerir de otros alimentos para su efectivo crecimiento. Alrededor de esta edad, los requerimientos de energía y nutrientes se incrementan, haciendo necesaria la introducción de una alimentación complementaria adecuada y de calidad, de origen natural, sin ultraprocesados ni azúcar añadida. Este proceso fisiológico se da paulatinamente, por lo que la leche materna continúa jugando un importante papel nutricional, inmunológico, cultural y social (2, 5, 73, 74, 75, 76).
La recomendación de la OMS indica como principio rector de una alimentación complementaria apropiada el seguir con la lactancia materna a demanda, con tomas frecuentes, hasta los dos años o más y ofrecer una alimentación que responda a las necesidades del niño, es decir una alimentación perceptiva, que atienda a las señales de hambre y saciedad que transmite el niño y no a la creencia de que debe consumir un número determinado de cantidades de alimentos (73, 74, 77).
La lactancia materna protege a los lactantes tanto de la malnutrición por déficit como por exceso (78,79). Los protocolos para el manejo de la desnutrición grave no la contraindican; por el contrario, la fomentan e incluyen técnicas como la relactancia o la extracción de leche de la madre para garantizar su continuidad. Según la Resolución 2350 de 2020 (80) que establece las directrices para el manejo de la desnutrición en Colombia y está alineada con la actualización de la OMS en 2023 (81). para la prevención y tratamiento de la desnutrición aguda en menores de 5 años, el enfoque debe ser individualizado según la edad y la situación clínica del niño, garantizando el tratamiento y seguimiento según las directrices, siendo uno de los pilares del manejo nutricional el establecimiento o restablecimiento de la lactancia materna. Se recomienda, cuando esté indicado, la técnica de suplementación por succión (relactancia), como estrategia para alimentar al niño mientras se estimula la producción de leche materna, colocando al niño al pecho tan frecuentemente como sea posible, es decir, a libre demanda (80). El monitoreo debe ser riguroso, con un seguimiento cercano al crecimiento del niño y un acompañamiento constante a la madre durante el proceso de recuperación (80,81).
En el caso de niños con malnutrición, la lactancia materna continúa siendo fundamental. Se ha demostrado que el amamantamiento exclusivo durante los primeros seis meses de vida puede reducir significativamente la mortalidad infantil en niños desnutridos. Además, la leche materna es de fácil digestión y puede ayudar a mejorar la absorción de nutrientes en niños con dificultades para ganar peso (49,82).
La lactancia materna también desempeña un papel clave en la prevención de la obesidad. Un meta-análisis reveló que está asociada con un menor riesgo de obesidad en las etapas preescolar y escolar, mostrando un efecto protector dosis-respuesta frente a la obesidad infantil. (83). La leche materna proporciona una cantidad equilibrada de proteínas, grasas y carbohidratos que favorecen un crecimiento saludable y ayudan a prevenir el desarrollo de la obesidad. (84). Diversos estudios, especialmente en países industrializados, han demostrado el efecto protector de la lactancia materna, con una reducción del riesgo de obesidad que varía entre el 15% y el 38% (85).
Declaración 40
La lactancia materna no es la causa de los patrones selectivos de alimentación observados en algunos niños. Por lo tanto, no debe restringirse o suspenderse; en su lugar, se debe investigar y abordar la causa subyacente.
Justificación declaración 40
Diversos estudios han demostrado que la lactancia materna actúa como un factor protector frente a los trastornos alimentarios (86,87). Las propiedades beneficiosas de la leche humana son ampliamente reconocidas, pero una de las menos difundidas es su capacidad para enseñar a degustar una variedad de sabores. Este proceso de aprendizaje comienza incluso in útero, a través del líquido amniótico, permitiendo que el feto experimente distintos sabores derivados de los alimentos que consume la madre (88). Posteriormente, con la lactancia, el bebé sigue expuesto a esta diversidad de sabores, lo que facilita la aceptación de nuevos alimentos durante el segundo semestre de vida. Esto resalta la superioridad de la leche materna frente a las fórmulas infantiles, cuyo sabor permanece inalterado (89).
Una dieta saludable y variada en la madre lactante podría, en teoría, facilitar la aceptación de nuevos alimentos en la infancia, lo que contribuiría al desarrollo de hábitos de alimentación saludable en los primeros años de vida. Esto podría ser una de las intervenciones más efectivas para reducir el riesgo de problemas de selectividad alimentaria en la niñez (90).
Es importante destacar que la alimentación complementaria a la lactancia materna no solo cumple una función nutricional. A partir del segundo semestre de vida, el bebé comienza a desarrollar habilidades oro-motoras, además de probar nuevos sabores, texturas y modos de alimentación (75). En esta etapa, la madre o cuidador asume un rol más activo al decidir qué alimentos ofrecer al niño, mientras este regula la cantidad que consume. Esto también permite que la madre interprete las señales de hambre y saciedad del bebé, promoviendo una alimentación perceptiva que respete estas señales (91).
En casos de niños con selectividad alimentaria o con Trastorno de Evitación/Restricción de la Ingesta de Alimentos, no se recomienda suspender o limitar la lactancia materna, ya que es el alimento más seguro para el niño en ese momento. Interrumpirla podría aumentar el riesgo de rechazo a los alimentos que ya tolera. Cuando un niño presenta dificultades o patrones selectivos de alimentación, debe ser evaluado por un equipo multidisciplinario, que investigue las causas subyacentes de la selectividad y diseñe una terapia específica para manejar el problema (89, 90, 92).
Declaración 41
No se aconseja interrumpir la lactancia materna durante la noche con el objetivo de optimizar los patrones de sueño, dado que la estructura y organización del sueño son procesos de maduración que se desarrollan de manera independiente al amamantamiento.
Declaración 42
En un bebé amamantado a libre demanda, la succión nocturna favorece el mantenimiento de la lactancia.
Declaración 43:
No se recomienda administrar suplementos o fórmulas infantiles con la intención de extender los períodos de sueño del lactante. Intentar retrasar el vaciamiento gástrico para mantener al bebé más lleno de lo habitual no altera su proceso de maduración y, por lo tanto, no es aconsejable.
Justificación de las declaraciones 41 a 43
El sueño es un proceso fisiológico activo y cíclico, fundamental para todos los aspectos de la vida. Un patrón de sueño saludable contribuye al crecimiento, desarrollo, aprendizaje, memoria, eficiencia sináptica, regulación del comportamiento y las emociones, fortalecimiento del sistema inmunológico y la eliminación de sustancias neurotóxicas. Este proceso de maduración se desarrolla de manera armónica con las necesidades de alimentación desde el nacimiento (93).
El análisis de los componentes de la leche materna y sus variaciones diurnas y nocturnas ha permitido comprender mejor por qué los niños pueden lactar a libre demanda, tanto de día como de noche (93, 94). La leche materna ha sido definida como un "cronobiótico" exógeno, es decir, una sustancia que regula los ritmos biológicos internos, especialmente los circadianos. Durante la vida intrauterina, estos ritmos en el feto son controlados por hormonas maternas como la melatonina y el cortisol. Después del nacimiento, la leche materna, rica en nucleósidos, triptófano y melatonina, ayuda a sincronizar los ritmos biológicos del bebé (95). Estudios han mostrado que los lactantes amamantados tienen niveles más altos de 6-sulfatoximelatonina, un metabolito de la melatonina, en comparación con los alimentados con fórmula, lo que refleja la importancia del desarrollo neuroendocrino del bebé para sintetizar melatonina a partir del triptófano presente en la dieta (94, 95).
La alimentación con leche materna a libre demanda no impone restricciones en la frecuencia o duración de las tomas. Se recomienda a las madres amamantar cuando el bebé lo desee, reconociendo que ellos mismos regulan su ingesta mediante una combinación de succión nutritiva y no nutritiva. Alimentar al bebé de acuerdo con sus señales garantiza que reciba toda la nutrición diaria necesaria, observando un promedio de 8 a 12 tomas diarias, con intervalos que no necesariamente son regulares (2, 96, 97). En los recién nacidos a término, el sueño representa entre 16 y 18 horas diarias, ocupando más del 50 % de las primeras etapas de vida (2, 31, 93). Es bien conocida la relación entre la frecuencia, intensidad y duración de la succión con la producción de leche: cuanto más veces se amamante, tanto de día como de noche, mayor será la cantidad de leche producida (29, 31). Asimismo, la alimentación nocturna continua está asociada con un mayor volumen de leche y una mayor duración de la lactancia (2).
Los niños alimentados exclusivamente con leche materna presentan un vaciamiento gástrico más rápido debido a los componentes de la leche, lo que favorece una mejor digestibilidad y biodisponibilidad de los nutrientes, haciendo que se presenten despertares frecuentes (94, 98) El sueño es un proceso evolutivo que, a medida que el niño crece, se caracteriza por una disminución en los despertares nocturnos, que se adapta a las necesidades de cada bebé y está íntimamente ligado al desarrollo del ser humano. Por esta razón, no se requiere, ni recomienda suplementación adicional o complementos para prolongar sus horas de sueño (29, 99). Es importante entonces transmitir a los padres que esperar que un niño pequeño tenga un sueño profundo y prolongado no se ajusta a su capacidad fisiológica. Alinear las expectativas de los padres con esta realidad facilita su comprensión y ayuda a evitar frustraciones (93, 98).
Declaración 44
El colecho seguro beneficia la fisiología del sueño en los lactantes, aumenta la tasa de amamantamiento y mejora el descanso materno.
Declaración 45
Como profesional de la salud, la recomendación respecto al colecho se centra en proporcionar orientaciones para su práctica segura. La decisión de adoptar el colecho corresponde a cada familia.
Justificación declaraciones 44 y 45
El colecho promueve el inicio, la exclusividad y la duración de la lactancia materna (31). Cuando se practica de manera segura, el colecho ofrece una oportunidad de cercanía que refuerza el vínculo entre madre e hijo. Además, permite que la madre y el bebé duerman en sincronía, como se observa en sus movimientos y respiración, lo que contribuye a un descanso más reparador para la madre.
El colecho se asocia con un aumento en el número de tomas nocturnas, lo que facilita una mayor duración de la lactancia. Para que esta práctica sea segura tanto para el bebé como para la madre, es esencial que todas las familias que amamantan reciban asesoramiento sobre sus beneficios, las precauciones necesarias y las recomendaciones internacionales para su práctica segura. De este modo, la familia lactante podrá tomar decisiones informadas (2, 31, 96, 100, 101).
Declaración 46
No es necesario suspender la lactancia a una edad determinada; es una decisión de la familia lactante.
Declaración 47
Es importante conocer las ventajas de continuar con la lactancia materna después de los dos años, para que los padres puedan tomar decisiones informadas al respecto.
Justificación declaraciones 46 y 47
La recomendación actual establece que la lactancia materna debe mantenerse al menos hasta los dos años o hasta que el binomio madre-hijo lo desee. Durante los primeros seis meses de vida, la lactancia debe ser exclusiva, momento alrededor del cual se inicia la alimentación complementaria (73).
Se ha investigado la composición nutricional de la leche materna en madres que amamantan más allá de los dos años, revelando que sigue siendo una fuente esencial de proteínas, carbohidratos y ácidos grasos necesarios para el crecimiento infantil. De hecho, las concentraciones de grasas, proteínas y energía aumentan significativamente en la leche de madres que continúan amamantando más de 12 y 24 meses, en comparación con aquellas que lo hacen solo hasta el año. Se ha observado que las concentraciones de grasas y proteínas alcanzan su punto máximo en madres que amamantan por más de dos años, lo que refleja una adaptación de la composición de la leche a las crecientes necesidades energéticas de los niños en desarrollo, como se detalla en la tabla 4 (102, 103).
Tabla 4. Contenido nutricional de la leche humana en diferentes etapas. *p < 0,005. adaptado de Ref. 102.
Tabla 4. Contenido nutricional de la leche humana en diferentes etapas
|
Contenido |
1-12 meses |
12-24 meses |
>24 meses |
|
Carbohidrato (g/dL) |
6.8-7.3 |
6.4-7.3 |
5.8-6.9 |
|
Grasas (g/dL) |
2.8-3.9 |
3.5-7.1 |
6.4-9.4* |
|
Proteína (g/dL) |
0.9-1.30 |
0.8-1.35 |
1.25-2.4* |
|
Energía (kcal/dL) |
61-71 |
78.3-85.7 |
89-118 * |
*p < 0,005. Adaptado de Referencia 102.
Es importante destacar que la investigación sobre la composición de la leche humana es limitada, ya que existen variaciones interindividuales significativas a lo largo de las diferentes etapas de la lactancia. Sin embargo, estudios recientes han comenzado a proporcionar una mayor comprensión sobre la composición nutricional y la microbiota presente en la leche humana más allá de los primeros meses. Estos estudios indican que nutrientes como las proteínas y las grasas pueden fluctuar durante períodos prolongados de lactancia, con mayores concentraciones de proteínas en los primeros meses y un aumento progresivo en las concentraciones de grasas con el tiempo. Comprender esta evolución en la composición de la leche a largo plazo es fundamental para formular recomendaciones dietéticas adecuadas para los lactantes que continúan siendo amamantados durante más tiempo (102, 103).
Además de los beneficios nutricionales, la lactancia materna continuada también ofrece un valioso soporte inmunológico a un sistema que sigue desarrollándose. Igualmente, relevante es que la lactancia continuada proporciona una experiencia positiva para el binomio madre-hijo, favoreciendo un apego seguro y saludable, y generando efectos positivos en el neurodesarrollo y el comportamiento del niño (2).
A menudo, algunos padres expresan preocupaciones relacionadas con la presión social sobre la lactancia, algunas veces considerada prolongada. Por ello, es fundamental enfatizar la importancia de crear un entorno de apoyo en el que las decisiones individuales sean respetadas. La postura favorable de los profesionales de la salud en este tema es clave para que la lactancia se mantenga por el tiempo que el binomio madre-hijo desee, más allá de los dos años. Esto brinda tranquilidad a las familias que optan por continuar la lactancia, evitando que las madres se sientan presionadas a ocultar su decisión por miedo a ser juzgadas (2, 104, 105).
Apoyar y promover la lactancia materna más allá de los 2 años tiene efectos positivos en la salud del niño y de la madre. La duración de la lactancia materna en sociedades tradicionales oscila entre 2 y 4 años, llegando incluso hasta los 7 años, resaltando que la lactancia más allá de los 2 años es una práctica natural y beneficiosa para el crecimiento y desarrollo infantil (102, 104, 105).
Declaración 48
Cuando existe un diagnóstico o sospecha de alergia a las proteínas de la leche de vaca (APLV), se recomienda priorizar la continuación de la lactancia materna.
Justificación Declaración 48
La APLV es una de las alergias alimentarias más comunes en niños, con un impacto negativo en la calidad de vida de ellos y sus familias, con un costo económico considerable. Existen criterios diagnósticos y recomendaciones de manejo basadas en evidencia que deben ser tomadas en cuenta. Entre estas, se destaca la importancia de mantener la leche materna como la primera opción para niños con APLV (106, 107, 108, 109).
Estudios en humanos y animales han subrayado la relevancia de los factores presentes en la leche materna que pueden influir en la fisiopatología de la alergia y en la inducción de la tolerancia oral. Estas investigaciones sugieren que intervenciones selectivas, como la modificación de la dieta de la madre, pueden beneficiar al bebé al tiempo que se preserva la lactancia materna (106, 107, 108).
En un estudio clínico aleatorizado (JAMA 2019), se evaluó si evitar la suplementación con fórmula infantil al nacer reduce los riesgos de sensibilización a la proteína de la leche de vaca y/o alergias alimentarias, incluyendo la alergia a la leche de vaca, en lactantes. Los resultados mostraron que evitar la suplementación con fórmula infantil durante los primeros tres días de vida y promover la lactancia materna exclusiva disminuyó significativamente el riesgo de sensibilización a la proteína de la leche de vaca y de desarrollar alergias alimentarias. Esto sugiere que la sensibilización y las alergias alimentarias, en particular a la leche de vaca, pueden prevenirse principalmente al evitar el uso de fórmula infantil en los primeros días de vida y fomentar la lactancia materna exclusiva (110, 111).
Declaración 49
La falta de una prueba de VIH negativa en el último trimestre en una madre sin factores de riesgo para infección, cuando las pruebas anteriores han sido negativas, no justifica postergar el inicio de la lactancia en la primera hora de vida, a la espera del resultado de la prueba realizada durante el parto. Es importante explicar y discutir los riesgos y beneficios con la familia antes de tomar una decisión.
Declaración 50
Una gestante que convive con VIH, con buena adherencia al tratamiento y títulos no detectables de carga viral, que desee iniciar lactancia materna, debe recibir información completa sobre los beneficios y los riesgos de la lactancia. La lactancia debe ser exclusiva y se debe realizar un seguimiento más estrecho por el programa de VIH, asegurando antes del parto el consentimiento informado de la decisión conjunta.
Justificación Declaraciones 49 y 50
Es fundamental asegurar que se sigan las recomendaciones de las guías de monitoreo del VIH durante el embarazo, realizando pruebas de tamizaje en cada trimestre. Las Instituciones de salud deben garantizar la prueba rápida en menos de una hora para no retrasar el inicio de la lactancia en la primera hora de vida y su posterior impacto de adherencia exclusiva (35).
El grupo desarrollador del consenso y expertos consideró, que si una madre, sin factores de riesgo para infección por VIH (trabajadora sexual, consumidora de drogas inyectables o tener pareja que conviva con VIH) llega al parto con dos pruebas negativas y la tercera aún pendiente, se debe hacer un enfoque basado en el riesgo, ya que la posibilidad de que haya adquirido el VIH en el último trimestre es baja.
En el caso de una madre que convive con VIH que tiene una carga viral indetectable en el momento del parto y tanto ella como su bebé reciben la terapia antiviral adecuada, el riesgo de transmisión perinatal es cercano al 1%, y en algunos estudios es incluso menor (112). La OMS, en lugar de imponer una prohibición categórica, recomienda que las madres que viven con VIH y desean amamantar tengan la posibilidad de hacerlo (115). Adoptar una postura rígida en contra de la lactancia puede llevar a que la madre amamante en secreto, perdiendo oportunidades valiosas de educación, apoyo a la adherencia y seguimiento cercano. Por ello, es fundamental mantener una conversación abierta y una toma de decisiones compartida e informada entre la madre y el equipo de salud, analizando tanto los riesgos como los valores de la familia (112, 113, 114).
Es importante aclarar que, aunque las guías internacionales han avanzado en este tema, el contexto colombiano presenta desafíos particulares. En muchos casos, es difícil garantizar que las pacientes sigan el tratamiento y mantengan una carga viral indetectable durante largos periodos y que se realicen los controles mensuales de carga viral, como lo recomienda la literatura. Aunque la guía colombiana aún contraindica la lactancia materna en madres con VIH, podría ser necesario ajustarla para alinearse con las recomendaciones internacionales, siempre teniendo en cuenta las particularidades del sistema de salud colombiano (116).
Las guías americanas ya no prohíben formalmente la lactancia materna en madres que conviven con VIH (119), en Colombia la recomendación sigue siendo no promoverla de manera activa (35, 116). Sin embargo, en los casos en que una madre desee amamantar y cumpla con los criterios necesarios, se le debe proporcionar información completa antes del nacimiento sobre los riesgos y beneficios, y acompañarla en su decisión (117,118).
Es esencial que, si una madre con VIH opta por la lactancia materna, esta sea exclusiva, ya que la lactancia mixta aumenta el riesgo de transmisión por encima del 1% (113,115). Además, resulta fundamental alinear esta recomendación con la guía colombiana de VIH, la cual contempla la fórmula infantil dentro del plan de beneficios. Esta debe ser garantizada en aquellos casos en los que no se cumplan las condiciones necesarias para posibilitar la lactancia exclusiva (116).
En resumen, es posible avanzar hacia una recomendación más flexible, sin promover la lactancia como la primera opción en madres que conviven con VIH (119). Si una madre decide amamantar, conociendo plenamente los riesgos y beneficios, se le debe acompañar en el proceso y contar con un consentimiento informado, por escrito, firmado en cada institución.
Declaración 51
La certeza, la evidencia y la eficacia de los galactogogos sean naturales o farmacológicos, son limitados con respecto a la seguridad para la madre y/o el bebe, con el fin de aumentar el volumen de leche o influir en el peso de los niños. Por lo tanto, se recomienda priorizar la identificación y corrección de la causa subyacente de la baja producción de leche antes de considerar su uso.
Declaración 52
El empleo de medicamentos galactogogos debe reservarse para situaciones excepcionales, como en casos de hipogalactia verdadera o en la inducción de la lactancia. Su prescripción debe ser exclusiva por parte de personal médico, considerando la relación costo-beneficio, el conocimiento de sus efectos secundarios y tras proporcionar asesoramiento en lactancia.
Justificación declaraciones 51 y 52
La evidencia sobre la eficacia de los galactogogos para prolongar la lactancia materna (3, 4 y 6 meses) es limitada; la magnitud de este efecto es incierta debido a la alta heterogeneidad y falta de precisión en los estudios disponibles. Además, no está claro si algún galactogogo es superior a otro, y la información sobre efectos adversos es escasa, aunque los reportados suelen ser leves. Foong et al. (2020) realizaron una revisión sistemática que concluye que, si bien algunos galactogogos pueden mostrar potencial para mejorar la producción de leche, la evidencia que los respalda es generalmente de baja calidad, con alta variabilidad entre los estudios. En este contexto, es crucial abordar primero las causas subyacentes de la baja producción de leche, la técnica de lactancia, la frecuencia de las tomas y la salud materna y neonatal, antes de considerar el uso de galactogogos. Optimizar estos factores puede mejorar significativamente la lactancia sin necesidad de medicamentos o suplementos (120).
Un meta-análisis publicado en 2021, no muestra evidencia que el uso de metoclopramida sea efectiva en el incremento de la producción de leche, a pesar de que se demuestra un incremento de los niveles de prolactina asociadas a su uso, sobreponiéndose al efecto producido por la succión, por lo que se requieren estudios con muestras significativas (121).
Medicamentos como la domperidona deben ser prescritos únicamente por personal médico calificado, quienes deben evaluar cuidadosamente la relación costo-beneficio y los posibles efectos secundarios. Aunque se ha observado una percepción de eficacia en el aumento de la producción de leche con la domperidona, también se han reportado efectos adversos que podrían comprometer la salud de la madre y el bebé (122, 123, 124).
Se recomienda restringir el uso de galactogogos farmacológicos a situaciones excepcionales, como la hipogalactia verdadera o la inducción de la lactancia, siendo necesaria una supervisión médica rigurosa (122, 125).
Finalmente, es esencial promover un enfoque integral que priorice el apoyo emocional a las madres, fomentando prácticas de lactancia óptimas y creando un entorno de soporte. Esta estrategia no sólo abordaría de manera más efectiva la producción de leche, sino que también garantizaría el bienestar tanto de la madre como del bebé (126).
Declaración 53
Durante la gestación, el período posparto y a lo largo de toda la etapa de lactancia, es esencial que se realice una evaluación integral de las madres que tome en cuenta su estado psicoemocional, reconociendo su carácter dinámico y multifactorial. La intervención oportuna es fundamental, basándose en los riesgos detectados, para asegurar el bienestar de la díada y el éxito del proceso de lactancia. Para llevar a cabo esta evaluación de manera efectiva, se recomienda el uso de un instrumento de medición validado específicamente para este propósito.
Justificación declaración 53
La salud mental de las madres durante la lactancia está intrínsecamente relacionada con el bienestar tanto de la madre como del bebé. La lactancia materna desencadena la liberación de hormonas como la prolactina y la oxitocina, que no solo refuerzan el vínculo del binomio, sino que también promueven una sensación de bienestar en la madre, lo que puede reducir el riesgo de depresión. No obstante, cuando existen problemas de salud mental sin detectar, como la depresión posparto, estos pueden afectar negativamente la lactancia, lo que a su vez incrementa los síntomas depresivos, creando un ciclo de retroalimentación negativo (2, 127).
La detección oportuna de trastornos de salud mental, mediante el uso de herramientas validadas como la Escala de Depresión Postnatal de Edimburgo (EPDS) (128), permite identificar a las madres en riesgo y brindar intervenciones preventivas. Parámetro de evaluación que se encuentra incluido en la ruta integral de salud del ministerio de Salud y protección social (35). Estas herramientas han demostrado mejorar significativamente la detección de síntomas depresivos en etapas clave, como el embarazo y el posparto. La depresión durante el embarazo predice una duración más corta de la lactancia y puede exacerbar la depresión posparto si no se interviene adecuadamente (129, 130).
El manejo integral de la salud psicoemocional de las madres, basado en evaluaciones y herramientas de detección, deben ser aplicadas de manera rutinaria y sistemática, capacitándose al personal de salud en su uso adecuado y en la interpretación de los resultados, activando en caso de ser necesario la ruta de atención multidisciplinaria (35). Un seguimiento continuo en cada etapa pre y postnatal es fundamental para apoyar a las madres, fortalecer la lactancia y promover un entorno familiar saludable (131).
Conclusiones
Existen múltiples directrices, tanto nacionales como internacionales, que subrayan los beneficios comprobados de la lactancia materna para las madres, los niños y la sociedad en general. Sin embargo, implementar estos lineamientos en la práctica diaria implica desafiar paradigmas preestablecidos, especialmente en áreas que generan controversia. Esta disparidad de enfoques entre los profesionales de la salud que acompañan a las familias lactantes puede provocar inseguridades y una baja adherencia a la lactancia.
Este consenso es un proceso colaborativo en el que participaron expertos con diferentes perspectivas, pero alineados en un objetivo común: promover, proteger y apoyar la lactancia materna en nuestro país, buscando acuerdos y unificación de criterios en temas controvertidos.
Reúne a organizaciones no gubernamentales y sociedades científicas representadas por profesionales de todas las áreas involucradas en la atención del binomio madre-hijo y de las familias lactantes, provenientes de diversas regiones del país. Utilizando la herramienta Delphi en tiempo real, se permitió la participación activa de estos expertos, quienes, basándose en una revisión exhaustiva de la literatura científica y en sus conocimientos y experiencias, realizaron un análisis objetivo y fiable que culminó en el consenso sobre 53 declaraciones propuestas.
Las discusiones generadas en las reuniones presenciales crearon un ambiente de intercambio constructivo, donde la escucha activa y el aporte de experiencias y evidencias permitieron la formulación y reformulación de posturas clave. Al ser sometidas a votación, estas posturas fueron apoyadas y se convirtieron en referencias útiles para aquellos encargados de transmitir información sobre lactancia a madres y familias. Este proceso resalta la necesidad continua de actualizarse, revisar nuevas evidencias científicas y generar nuevos consensos con tópicos no tratados en este y dar protagonismo a un tema crucial para el bienestar de los niños en el país.
Los resultados de este consenso establecen una base sólida para la discusión futura sobre las prácticas de lactancia materna en nuestro país, así como para acompañar el desarrollo de políticas y acuerdos tanto regionales como nacionales. Este trabajo refuerza el vínculo entre la salud pública y la atención clínica, subrayando la importancia de la lactancia materna en el bienestar general de la población. Siendo responsabilidad de todos, difundir y aplicar las directrices de este consenso y cumplir así el objetivo propuesto.
Conflictos de interés
Todos los autores han declarado no tener conflictos de interés individuales, conforme a las normativas del Comité Internacional de Editores de Revistas Médicas (ICMJE) y de la Revista Pediatría. La selección de los expertos fue realizada por las respectivas agremiaciones, lo que garantiza la ausencia de sesgos en la elección de los participantes por parte de los autores. No se recibió apoyo económico de ningún tipo para la realización de este consenso.
Agradecimientos
Agradecemos a la Sociedad Colombiana de Pediatría y a su Presidente Dr Mauricio Guerrero y a la Asociación Colombiana de Nutrición Clínica, y a su Presidente Dra Diana Trejos, y ex-presidente Angelica Pérez por su apoyo en el proceso de organización del consenso.
Organizaciones Participantes
● Asociación Colombiana de Neonatología:
○ Centro: Dra. Julieta Castro, Dra. Diana Arias
○ Santander: Dr. Richard Claro
○ Atlántico: Dra. Diana Maestre
○ Antioquia: Dra. Alicia Lucía Ballesteros, Dra. Gloria Patricia Duque
○ Huila: Dra. María Carmenza Cuenca
● Colegio Colombiano de Gastroenterología Hepatología y Nutrición Pediátrica:
○ Dra. Ailim Margarita Carías
○ Dra. Claudia Liliana Losada
○ Nd Nora Alvarez
● Asociación Colombiana de Infectología:
○ Dr. Juan Pablo Londoño
● Federación Colombiana de Obstetricia y Ginecología:
○ Dr. Saulo Molina
○ Dr. Francisco Edna
● Asociación Bogotana de Perinatología y Medicina Materno Fetal:
○ Dr. Mortimer Arreaza
○ Dra. Andrea Catalina Avellaneda
● Asociación Colombiana de Dietistas y Nutricionistas:
○ Nd Luis Miguel Becerra
● Colegio Colombiano de Nutricionistas Dietistas:
○ Nd Nelly Patricia Castillejo
● Organización Colegial de Enfermería:
○ Lic. Ariadna María Angarita
○ Lic. Alix Natalia Vargas
○ Lic. María Alejandra Alarcón
● Colegio Colombiano de Terapia Ocupacional:
○ TO Diana Guerrero
● Red Latinoamericana de Salud Mental Perinatal:
○ Psc Natalia Castillo
● Asociación Colombiana de Fonoaudiología:
○ Fga Mónica Perdomo
● Academia Colombiana de Odontología Pediátrica:
○ Dra. Liliana María Ortiz
● Sociedad Colombiana de Pediatría:
○ Regional Antioquia: Dra. Mónica María Castaño
○ Regional Boyacá: Dra. Erica Natalia Ávila
○ Regional Bolívar: Dra. Suanny del Carmen González
○ Regional Caquetá: Dra. Carmen Rossy Ramírez
○ Regional Caldas: Dr. Aníbal Rueda
○ Regional Cauca: Dra. Jeimmy Carolina Carreño
○ Regional Cesar: Dra. Luz Angela Arrieta
○ Regional Córdoba: Dra. Sandra Milena Negrete
○ Regional Girardot: Dr. Cesar Augusto Mayorga
○ Regional Huila: Dra. Edna Lizeth Castrillón
○ Regional Magdalena: Dra. Liz Gómez
○ Regional Meta: Dr. Cesar Bernardo Villarraga
○ Regional Nariño: Dra. Jenny Patricia Erazo
○ Regional Norte de Santander: Dr. Diego Andrés Blanco
○ Regional Quindío: Dr. Carlos Alberto Ríos
○ Regional Risaralda: Dra. Natalia Fernández
○ Regional Santander: Dra. Natalia Páez
○ Regional Tolima: Dra. Sofía Loreney Lagos
○ Regional Valle del Cauca: Dr. Camilo Andrés Vargas
● UNICEF
○ Dr. Diego Góngora
Referencias
1. Jack A, Mullin C, Brown E, Burtner M, Standish KR, Fields A, et al Academy of Breastfeeding Medicine Clinical Protocol #19: Breastfeeding Promotion in the Prenatal Period (Revised 2024). Breastfeed Med. 2024 Aug;19(8):575-587. doi: 10.1089/bfm.2024.0203. PMID: 39186728.
2. Schanler, R. J. (Ed.). Breastfeeding Handbook for Physicians (3rd ed.).2023. American Academy of Pediatrics.
3. Organización Mundial de la Salud.Código Internacional de Comercialización de Sucedáneos de la Leche Materna. Ginebra (1981). Available from: https://www.who.int/es/publications/i/item/9241541601
4. Decreto 1397 de 1992. Por el cual se promueve la lactancia materna, se reglamenta la comercialización y publicidad de los alimentos de fórmula para lactantes y complementarios de la leche materna y se dictan otras disposiciones. Available from: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/INEC/IGUB/decreto-1397-de-1992.pdf
5. Fewtrell, M., Bandsma, R. H. J., Baur, L., Duggan, C. P., Dumrongwongsiri, O., Hojsak, I.,et al. Role of Pediatricians in Promoting and Supporting Breastfeeding: A Position Paper of the International Pediatric Association Strategic Advisory Group on Infant, Child, and Adolescent Nutrition. Ann Nutr Metab. 2023 79(6), 469–475. https://doi.org/10.1159/000534004
6. Ley 2361 de 2024. Por medio del cual se otorgan lineamientos para la creación de la política pública de lactancia materna, alimentación complementaria y la promoción de los bancos de leche humana como componente anatómico. 14 de junio de 2024 en: https://consultorsalud.com/ley-2361-2024-polit-lactancia-materna-col/
7. Naciones Unidas. Informe de los objetivos de desarrollo sostenible. Edición Especial [INTERNET]. United Nations Publications, 2023. Cited September 17 2024. Available from: https://www.un.org/sustainabledevelopment/es/hunger/
8. JuC Gnatzy T, Warth J, von der Gracht H et al. Validating an innovative real-time Delphi approach - A methodological comparison between real-time and conventional Delphi studies. Technological Forecasting and Social Change 2011;78(9):1681-1694.
9. Nasa P, Jain R, Juneja D. Delphi methodology in healthcare research: How to decide its appropriateness. World J Methodol. 2021 Jul 20;11(4):116-129. doi: 10.5662/wjm.v11.i4.116. PMID: 34322364; PMCID: PMC8299905.
10. Niederberger M. , Spranger J. Delphi Technique in Health Sciences: A Map.Front Public Health.. 2020. Vol 8 .DOI=10.3389/fpubh.2020.00457. ISSN=2296-2565 https://www.frontiersin.org/journals/public-health/articles/10.3389/fpubh.2020.00457/full
11. Taber, K.S. The Use of Cronbach's Alpha When Developing and Reporting Research Instruments in Science Education. Res Sci Educ,2018, 48, 1273–1296
12. Rollins, N., Piwoz, E., Baker, P., Kingston, G., Mabaso, K. M., McCoy, D., et al. Lancet Breastfeeding Series Group. Marketing of commercial milk formula: a system to capture parents, communities, science, and policy. Lancet (London, England). 2023 401(10375), 486–502. https://doi.org/10.1016/S0140-6736(22)01931-6
13. Pérez-Escamilla, R., Tomori, C., Hernández-Cordero, S., Baker, P., Barros, A. J. D., Bégin, F., et al. Lancet Breastfeeding Series Group. Breastfeeding: crucially important, but increasingly challenged in a market-driven world. Lancet (London, England). 2023 401(10375), 472–485. https://doi.org/10.1016/S0140-6736(22)01932-8
14. Cheung KY, Petrou L, Helfer B, Porubayeva E, Dolgikh E, Ali S, et al. Health and nutrition claims for infant formula: international cross sectional survey. BMJ. 2023 Feb 15;380:e071075. doi: 10.1136/bmj-2022-071075. PMID: 36792145; PMCID: PMC9930154.
15. D'Hollander, C. J.,
McCredie, V. A., Uleryk, E. M., Keown-Stoneman, C. D. G., Birken, C. S.,
O'Connor, D. L.,et al. Breastfeeding support provided by lactation consultants
in high-income countries for improved breastfeeding rates, self-efficacy, and
infant growth: a systematic review and meta-analysis protocol. Systematic
reviews. 2023 12(1), 75.
https://doi.org/10.1186/s13643-023-02239-9.
16. Gavine, A., Shinwell,
S. C., Buchanan, P., Farre, A., Wade, A., Lynn, F., et al. Support for healthy
breastfeeding mothers with healthy term babies. Cochrane Database Syst Rev.
2022 10(10), CD001141.
https://doi.org/10.1002/14651858.CD001141.pub6…
17. Meek,J.Y., Lawrence Noble. Section on Breastfeeding; Policy Statement: Breastfeeding and the Use of Human Milk. Pediatrics. July 2022 150 (1): e2022057988. 10.1542/peds.2022-057988
18. Kaya Ö, Tecik S, Suzan ÖK, Kabul F, Koyuncu O, Çınar N. The effect of interventions on flat and inverted nipple on breastfeeding: A systematic review. J Pediatr Nurs. 2024 Jan-Feb;74:e1-e13. doi: 10.1016/j.pedn.2023.07.024. Epub 2023 Aug 8. PMID: 37558567
19. Forster, D. A.,
Moorhead, A. M., Jacobs, S. E., Davis, P. G., Walker, S. P., McEgan, K. M.
Advising women with diabetes in pregnancy to express breastmilk in late
pregnancy (Diabetes and Antenatal Milk Expressing [DAME]): a multicentre,
unblinded, randomised controlled trial. Lancet (London, England). 2017
389(10085), 2204–2213.
https://doi.org/10.1016/S0140-6736(17)31373-9
20. Demirci JR, Glasser M, Himes KP, Sereika SM. Structured antenatal milk expression education for nulliparous pregnant people: results of a pilot, randomized controlled trial in the United States. Int Breastfeed J. 2022 Jul 7;17(1):50. doi: 10.1186/s13006-022-00491-8. PMID: 35799299; PMCID: PMC9261047.
21. Foudil-Bey, I., Murphy, M. S. Q., Dunn, S., Keely, E. J., & El-Chaâr, D. Evaluating antenatal breastmilk expression outcomes: a scoping review. Int Breastfeed J. 2021 16(1), 25. https://doi.org/10.1186/s13006-021-00371-
22. Chen J, Zhu XM, Huynh
MNQ, McRae M. Breastfeeding Outcome and Complications in Females With Breast
Implants: A Systematic Review and Meta-Analysis. Aesthet Surg J. 2023 Jun
14;43(7):731-740.
doi: 10.1093/asj/sjad027. PMID: 36752943
23. Kraut, R. Y., Brown, E., Korownyk, C., Katz, L. S., Vandermeer, B., Babenko, O.,et al. The impact of breast reduction surgery on breastfeeding: Systematic review of observational studies. PloS one. 2017 12(10), e0186591. https://doi.org/10.1371/journal.pone.0186591
24. Davanzo R. Controversies in Breastfeeding. Front Pediatr. 2018 Nov 1;6:278. doi: 10.3389/fped.2018.00278. PMID: 30443539; PMCID: PMC6221984.
25. Minh LHN, Tawfik GM, Ghozy S, Hashan MR, Nam NH, Linh LK, et al. Feto-Maternal Outcomes of Breastfeeding during Pregnancy: A Systematic Review and Meta-Analysis. J Trop Pediatr. 2021 Dec 8;67(6):fmab097. doi: 10.1093/tropej/fmab097. PMID: 34962568.
26. Shenker, N. S., Perdones-Montero, A., Burke, A., Stickland, S., McDonald, J. A. K., & Cameron, S. J. S. Human Milk from Tandem Feeding Dyads Does Not Differ in Metabolite and Metataxonomic Features When Compared to Single Nursling Dyads under Six Months of Age. Metabolites. 2022 12(11), 1069. https://doi.org/10.3390/metabo12111069
27. Rosenberg, G.,
Mangel, L., Mandel, D., Marom, R., & Lubetzky, R. Tandem Breastfeeding and
Human Milk Macronutrients: A Prospective Observational Study. J Hum Lact. 2021
37(4), 723–729.
https://doi.org/10.1177/08903344211003827
28. Stalimerou, V.,
Dagla, M., Vivilaki, V., Orovou, E., Antoniou, E., & Iliadou, M.
Breastfeeding During Pregnancy: A Systematic Review of the Literature. Maedica (Bucur).
2023 18(3), 463–469.
https://doi.org/10.26574/maedica.2023.18.3.463
29. Lawrence R. Biochemistry of Human Milk. In: Lawrence RA, Lawrence RM. Eds. Breastfedding: A guide for the medical profession. 7 Edition. Philadelphia. Elsevier, Inc. 2022:93-144.
30. United Nations Children’s Fund (UNICEF), World Health Organization, Implementation guidance on counseling Women to improve Breastfeeding Practices. New York. United Nations Children’s Fund. 2021. Available from: www.globalbreastfeedingcollective.org
31. Grupo de trabajo de la Guía de Práctica Clínica sobre lactancia materna. Guía de Práctica Clínica sobre lactancia materna. Ministerio de Sanidad, Servicios Sociales e Igualdad; Agencia de Evaluación de Tecnologías Sanitarias del País Vasco-OSTEBA, 2017. Guías de Práctica Clínica en el SNS
32. Feldman-Winter, L., Kellams, A., Peter-Wohl, S., Taylor, J. S., Lee, K. G., Terrell, M. J.,et al. Evidence-Based Updates on the First Week of Exclusive Breastfeeding Among Infants ≥35 Weeks. Pediatrics. 2020 145(4), e20183696. https://doi.org/10.1542/peds.2018-3696
33. Kellams A, Harrel C,
Omage S, Gregory C, Rosen-Carole C. ABM Clinical Protocol #3: Supplementary
Feedings in the Healthy Term Breastfed Neonate, Revised 2017. Breastfeed Med.
2017 May;12:188-198.
https://doi: 10.1089/bfm.2017.29038.ajk. Epub 2017 Mar 15. PMID: 28294631.
34. Ministerio de la Protección Social, OMS, OPS. Anexo 2. Lineamientos para la implementación y fortalecimiento de la estrategia IAMII, Instituciones Amigas de la Mujer y la Infancia Integral. Colombia. Noviembre de 2016. Available from: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/PP/SNA/lineamientos-iami-2016.pdf
35. Resolución 3280 de 2018. Por medio de la cual se adoptan los lineamientos técnicos y operativos de la Ruta Integral de Atención para la Promoción y Mantenimiento de la Salud y la Ruta Integral de Atención en Salud para la Población Materno Perinatal y se establecen las directrices para su operación Available from: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/DE/DIJ/resolucion-3280-de-2018.pdf)
36. Ley 2244 de 2022: parto digno y humanizado. Available from: http://www.secretariasenado.gov.co/senado/basedoc/ley_2244_2022.html )
37. Hoyt-Austin AE, Kair
LR, Larson IA, Stehel EK; Academy of Breastfeeding Medicine. Academy of
Breastfeeding Medicine Clinical Protocol #2: Guidelines for Birth
Hospitalization Discharge of Breastfeeding Dyads, Revised 2022. Breastfeed Med. 2022
Mar;17(3):197-206.
doi: 10.1089/bfm.2022.29203.aeh. PMID: 35302875; PMCID: PMC9206473.
38. Dennis, C. The Breastfeeding Self‐Efficacy Scale: Psychometric Assessment of the Short Form. J Obstet Gynecol Neonatal Nurs. 2003 32(6), 734–744. https://doi.org/10.1177/0884217503258459
39. Dennis, C.-L., & Faux, S. Development and Psychometric Testing of the Breastfeeding Self-Efficacy Scale. Res Nurs Health. 1999 (Vol. 22).
40. Trujillo, A., Castro-Osorio, R., Maldonado-Avendaño, N. Traducción y validación de la Escala de Autoeficacia en Lactancia Materna bses-sf en población colombiana. 2024. Av Piscol Clin Latinonot, 42(1), 1-20. https:// doi.org/10.12804/revistas.urosario.edu.co/apl/a.13013
41. Tuthill, E. L., McGrath, J. M., Graber, M., Cusson, R. M., & Young, S. L.. Breastfeeding Self-efficacy: A Critical Review of Available Instruments. J Hum Lact. 2016 (Vol. 32, Issue 1, pp. 35–45).
42. Centers for Disease Control and Prevention. Proper Storage and Preparation of Breast Milk. Cited march 5 2024. Available from: https://www.cdc.gov/breastfeeding/reclommendations/handling_breastmilk.htm#
43. Lozano, G. B., & Antón, B. F. Aspectos prácticos de la extracción, conservación y administración de leche materna en el hogar/Practical aspects of expressing, storing and handling breast milk in the home. Acta Pediatr Esp. 2016 74(7), E149.
44. Eglash, A., Simon, L., & Academy of Breastfeeding Medicine. ABM Clinical Protocol #8: Human Milk Storage Information for Home Use for Full-Term Infants, Revised 2017. Breastfeed Med. 2017 12(7), 390–395. https://doi.org/10.1089/bfm.2017.29047.aje
45. Gao, C., Miller, J., Middleton, P. F., Huang, Y. C., McPhee, A. J., & Gibson, R. A. Changes to breast milk fatty acid composition during storage, handling and processing: A systematic review. Prostaglandins, leukotrienes, and essential fatty acids. 2019 146, 1–10. https://doi.org/10.1016/j.plefa.2019.04.008
46. Ministerio de la Protección Social, Acción Social, UNICEF, Programa Mundial de Alimentos, Ochoa Parra G. Manual para la extracción, conservación, transporte y suministro de la leche materna, para mujeres gestantes y madres en periodos de lactancia, agentes de salud y comunitarios. Colombia, 2014. Available from: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/PP/SNA/Manual-extraccion-conservacion-leche-materna.pdf
47. Brahm, P., & Valdés, V. Beneficios de la lactancia materna y riesgos de no amamantar. Rev Chil Pediatr. 2017 88(1), 7–14. https://doi.org/10.4067/S0370-41062017000100001
48. Feldman-Winter, L.,
Burnham, L., Grossman, X., Matlak, S., Chen, N., & Merewood, A. Weight gain
in the first week of life predicts overweight at 2 years: A prospective cohort
study. Matern
Child Nutr. 2018 14(1), e12472.
https://doi.org/10.1111/mcn.12472
49. Victora CG, Bahl R,
Barros AJ, França GV, Horton S, Krasevec J, et al.Lancet Breastfeeding Series
Group. Breastfeeding in the 21st century: epidemiology, mechanisms, and
lifelong effect. Lancet.
2016 Jan 30;387(10017):475-90.
doi: 10.1016/S0140-6736(15)01024-7. PMID: 26869575.
50. OMS, UNICEF. Protecting, promoting and supporting breastfeeding in facilities providing maternity and newborn services: implementing the revised Baby-friendly Hospital Initiative 2018. Ginebra, 2019)
51. Tolppola, O., Renko, M., Sankilampi, U., Kiviranta, P., Hintikka, L., & Kuitunen, I. Pacifier use and breastfeeding in term and preterm newborns-a systematic review and meta-analysis. Eur J Pediatr. 2022 181(9), 3421–3428. https://doi.org/10.1007/s00431-022-04559-9
52. Dos Santos, D. A.,
Giugliani, C., Bizon, A. M. B. L., & Justo Giugliani, E. R. Nipple shield
use in the maternity ward increases risk of exclusive breastfeeding
interruption in the first six months of infant's life. Midwifery. 2024
128, 103873.
https://doi.org/10.1016/j.midw.2023.103873.
53. Coentro, V. S., Perrella, S. L., Lai, C. T., Rea, A., Murray, K., & Geddes, D. T. Effect of nipple shield use on milk removal: a mechanistic study. BMC Pregnancy Childbirth. 2020 20(1), 516. https://doi.org/10.1186/s12884-020-03191-5
54. Chow, S., Chow, R., Popovic, M., Lam, H., Merrick, J., Ventegodt, S., et al. The Use of Nipple Shields: A Review. Front Public Health. 2015 3, 236. https://doi.org/10.3389/fpubh.2015.00236
55. Children’s Health Ireland. Guideline for the use of Nipple shields in CHI at Crumlin. Jan 2022. Available from: https://media.childrenshealthireland.ie/documents/breastfeeding-nipple-shields-2022.pdf
56. Hernández MT, Bartick M, Scherck P, Harrel C, Academy of Breastfeeding Medicine. ABM Clinical Protocol #7. Model Maternity Policy Supportive of Breastfeeding. Breastfeed Med. 2018 Volume 13, Number 9 DOI: 10.1089/bfm.2018.29110.mha
57. LeFort Y, Evans A, Livingstone V, Douglas P, Dahlquist N, Donnelly B, Leeper K, Harley E, Lappin S. Academy ofBreastfeeding Medicine Position Statement on Ankyloglossia in Breastfeeding Dyads. Breastfeed Med. 2021Apr;16(4):278-281. doi: 10.1089/bfm.2021.29179.ylf. PMID: 33852342.
58. Jacome Orozco , Álvaro L., Patiño Garnica, C. S., & Brito, C. Anquiloglosia, enfoque multidisciplinario: serie de casos. Pediatría. 2023, 55(4), 193–200. https://doi.org/10.14295/rp.v55i4.413
59. Knight, M., Ramakrishnan, R., Ratushnyak, S., Rivero-Arias, O., Bell, J., Bowler, U., et al.FROSTTIE Trial Collaborative Group. Frenotomy with breastfeeding support versus breastfeeding support alone for infants with tongue-tie and breastfeeding difficulties: the FROSTTIE RCT. Health technology assessment (Winchester, Engl) 2023 https://doi.org/10.3310/WBBW2302
60. Flaherman, V. J.,
Schaefer, E. W., Kuzniewicz, M. W., Li, S. X., Walsh, E. M., & Paul, I. M.
Early weight loss nomograms for exclusively breastfed newborns. Pediatrics. 2015
135(1), e16–e23.
https://doi.org/10.1542/peds.2014-1532 161471
61. Jayaraj D, Rao S,
Balachander B. Predisposing factors for excessive loss of weight in exclusively
breastfed term and late preterm neonates - a case control study. J Matern Fetal
Neonatal Med. 2022 Aug;35(16):3083-3088.
doi: 10.1080/14767058.2020.1808617. Epub 2020 Aug 30. PMID: 32862736.
62. Miller, J. R.,
Flaherman, V. J., Schaefer, E. W., Kuzniewicz, M. W., Li, S. X., Walsh, E.
M.,et al. Early weight loss nomograms for formula fed newborns. Hosp pediatr. 2015 5(5), 263–268.
https://doi.org/10.1542/hpeds.2014-0143
63. Penn State Health, Children's Hospital, Children’s Miracle Network Hospitals Newt - Newborn Weight Loss Tool. Cited Febr 2024. Available at: https://www.newbornweight.org/.
64. Sarmiento-Aguilar, A., Horta-Carpinteyro, D., & Prian-Gaudiano, A. Percentage of birth weight loss as a reference for the well-being of the exclusively breastfed newborn. Bol Med Hosp Infant Mex. 2022 79(6), 341–349. https://doi.org/10.24875/BMHIM.22000032
65. Giudicelli M, Hassler
M, Blanc J, Zakarian C, Tosello B. Influence of intrapartum maternal fluids on
weight loss in breastfed newborns. J Matern Fetal Neonatal Med. 2022
Feb;35(4):692-698.
doi: 10.1080/14767058.202kddxfcxcx0.1731453. Epub 2020 Feb 20. PMID: 32079436.
66. National Guideline Alliance (UK). Faltering Growth – recognition and management. London: National Institute for Health and Care Excellence (NICE); 2017 Sep. (NICE Guideline, No. 75.) 4, Weight loss in the early days of life. Available from: https://www.ncbi.nlm.nih.gov/books/NBK536449
67. Miyoshi, Y., Suenaga, H., Aoki, M. et al. Determinants of excessive weight loss in breastfed full-term newborns at a baby-friendly hospital: a retrospective cohort study. Int Breastfeed J 15, 19 (2020). https://doi.org/10.1186/s13006-020-00263-2
68. Lavagno C, Camozzi P,
Renzi S, Lava SA, Simonetti GD, Bianchetti MG, Milani GP.
Breastfeeding-Associated Hypernatremia: A Systematic Review of the Literature. J Hum Lact. 2016
Feb;32(1):67-74.
doi: 10.1177/0890334415613079. Epub 2015 Nov 3. PMID: 26530059.
69. Arora I, Juneja H,
Bhandekar H, Chandankhede M. Neonatal hypernatremic dehydration in breastfed
neonates: a prospective study unmasking the influences of breastfeeding
practices and early weight monitoring. J Matern Fetal Neonatal Med. 2023
Dec;37(1):2299568.
doi: 10.1080/14767058.2023.2299568. Epub 2023 Dec 27. PMID: 38151267.
70. Hubbard, E. M., & Hay, W. W., Jr. The Term
Newborn: Hypoglycemia. Clin Perinatol. 2021 48(3), 665–679.
https://doi.org/10.1016/j.clp.2021.05.013
71. Wight NE; Academy of
Breastfeeding Medicine. ABM Clinical Protocol #1: Guidelines for Glucose
Monitoring and Treatment of Hypoglycemia in Term and Late Preterm Neonates,
Revised 2021. Breastfeed
Med. 2021 May;16(5):353-365.
doi: 10.1089/bfm.2021.29178.new. Epub 2021 Apr 7. PMID: 33835840.
72. Adamkin D. H. Neonatal hypoglycemia.
Seminars in fetal & neonatal medicine. 2017 22(1), 36–41.
https://doi.org/10.1016/j.siny.2016.08.007
73. WHO. Infant and young child feeding. Cited August 9 2023. Available from: https://www.who.int/es/news-room/fact-sheets/detail/infant-and-young-child-feeding
74. CDC Nutrition. How Much and How Often to Breastfeed. Cited May 9 2024. Available from:
https://www.cdc.gov/nutrition/infantandtoddlernutrition/breastfeeding/how-much-and-how-often.html
75. Vázquez-Frias,R., Ladino,L., Bagés-Mesa, MC., Hernández-Rosiles,V., Ochoa-Ortiz, E., Alomía,M., Bejarano, R., Boggio-Marzet, C. et al. Consenso de alimentación complementaria de la Sociedad Latinoamericana de Gastroenterología, Hepatología y Nutrición Pediátrica: COCO 2023,Rev Gastroenterol Mex, 2023. Volume 88, Issue 1, Pages 57-70, (99) WHO. Infant and young child feeding. Cited August 9, 2023. Available from: https://www.who.int/es/news-room/fact-sheets/detail/infant-and-young-child-feeding
76. Ministerio de Salud y Protección
Social. Dirección de Promoción y Prevención Subdirección de Salud Nutricional,
Alimentos y Bebidas. Lineamiento para formación en Consejería en Lactancia
materna y Alimentación Complementaria. 2020.
https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/PP/SSNAB/lineamiento-consejeria-lactancia-materna-aliment-comp.pdf
77. United Nations Children’s Fund (UNICEF). Improving Young Children’s Diets During the Complementary Feeding Period. UNICEF Programming Guidance. New York: UNICEF, 2020. Available from:
https://www.unicef.org/media/93981/file/Complementary-Feeding-Guidance-2020.pdf
78. Ibrahim, C., Bookari, K., Sacre, Y., Hanna-Wakim, L., & Hoteit, M. Breastfeeding Practices, Infant Formula Use, Complementary Feeding and Childhood Malnutrition: An Updated Overview of the Eastern Mediterranean Landscape. Nutrients. 2022 14(19), 4201. https://doi.org/10.3390/nu14194201
79. de Onis, M., Onyango,
A., Borghi, E., Siyam, A., Blössner, M., Lutter, C., & WHO Multicentre
Growth Reference Study Group. Worldwide implementation of the WHO Child Growth
Standards. Public Health Nutr. 2012 15(9), 1603–1610 .
https://doi.org/10.1017/S136898001200105X
80. Lineamiento para el manejo integrado de la desnutrición aguda moderada y severa en niños y niñas de 0 a 59 meses de edad. Resolucion 2350 de 2020. Available from: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/PP/SA/lineamiento-manejo-desnutricion-resolucion-2350.pdf
81. World Health Organization. (2023). WHO guideline on the prevention and management of wasting and nutritional oedema (acute malnutrition) in infants and children under 5 years. World Health Organization. Available from: https://iris.who.int/handle/10665/376075. Licencia: CC BY-NC-SA 3.0 IGO
82. Chong, H. Y., Tan, L.
T., Law, J. W., Hong, K. W., Ratnasingam, V., Ab Mutalib, N. S., et al.
Exploring the Potential of Human Milk and Formula Milk on Infants' Gut and
Health. Nutrients. 2022 14(17), 3554.
https://doi.org/10.3390/nu14173554
83. Jia Qiao, Li-Jing Dai, Qing Zhang, Yan-Qiong Ouyang, A Meta-Analysis of the Association Between Breastfeeding and Early Childhood Obesity, Journal of Pediatric Nursing, Volume 53, 2020,
84. Dewey, K., Bazzano, L., Davis, T., Donovan, S., Taveras, E., Kleinman, R., et al. Güngör. The Duration, Frequency, and Volume of Exclusive Human Milk and/or Infant Formula Consumption and Overweight and Obesity: A Systematic Review. USDA Nutrition Evidence Systematic Review. 2020
85. Scherbaum V, Srour
ML. The Role of Breastfeeding in the Prevention of Childhood Malnutrition. World Rev Nutr Diet.
2016 115:82-97.
doi: 10.1159/000442075. Epub 2016 May 19. PMID: 27198529.
86. Ortega-Ramírez, A. D., Maneschy, I. R., Miguel-Berges, M. L., Pastor-Villaescusa, B., Leis, R., Babio, N., et al. Early feeding practices and eating behaviour in preschool children: The CORALS cohort. Matern Child Nutr, 2024. 20, e13672. doi.org/10.1111/mcn.13672
87. Maranhão HS, Aguiar RC, Lira DTJ, Sales MÚF, Nóbrega NÁDN. Feeding Difficulties in Preschool Children, Previous Feeding Practices, and Nutritional Status. Rev Paul Pediatr. 2017 Oct 30;36(1):7. doi: 10.1590/1984-0462/;2018;36;1;00004. PMID: 29091129; PMCID: PMC5849369.
88. Widström AM, Brimdyr K, Svensson K, Cadwell K, Nissen E. Skin-to-skin contact the first hour after birth, underlying implications and clinical practice. Acta Paediatr. 2019;108(7):1192-1204
89. Specht, I. O., Rohde, J. F., Olsen, N. J., & Heitmann, B. L. Duration of exclusive breastfeeding may be related to eating behaviour and dietary intake in obesity prone normal weight young children. PloS one. 2018 13(7)
https://doi.org/10.1371/journal.pone.0200388
90. Bravo J, Paulina, Hodgson B, M. Isabel. Trastornos alimentarios del lactante y preescolar. Rev Chil Pediatr. 2011 82(2), 87-92. https://dx.doi.org/10.4067/S0370-41062011000200002
91. Calzada-León R, Altamirano-Bustamante N, Ruiz-Reyes ML.Reguladores neuroendocrinos y gastrointestinales del apetito y la saciedad. Bol Med Hosp Infant Mex.;2018 65(6):468-487.
92. Saure C, Zonis LN, González Sanguineti X, Kovalskys I. Dificultades alimentarias en la infancia: una revisión narrativa. Arch Argent Pediatr. 2024;122(5):e202310200.
93. Caba-Flores, M. D., Ramos-Ligonio, A.,
Camacho-Morales, A., Martínez-Valenzuela, C., Viveros-Contreras, R., &
Caba, M. Breast Milk and the Importance of Chrononutrition. Front Nutr. 2022
9, 867507.
https://doi.org/10.3389/fnut.2022.867507
94. Echeverria, AC. Influencia del patrón de lactancia materna en el desarrollo del sueño en lactantes menores de 3 meses. Trabajo final de maestría. Bogotá. Universidad Nacional de Colombia. 2019. Available from: https://repositorio.unal.edu.co/bitstream/handle/unal/75861/1085253708.2020.pdf?sequence=1&isAllowed=y
95. Hahn-Holbrook, J., Saxbe, D., Bixby, C., Steele, C., & Glynn, L. Human milk as “chrononutrition”: implications for child health and development. Pediatric Research,2019. 85(7), 936–942. https://doi.org/10.1038/s41390-019-0368-x
96. Blair PS, Ball HL, McKenna JJ, Feldman-Winter L, Marinelli KA, Bartick MC; Academy of Breastfeeding Medicine. Bedsharing and Breastfeeding: The Academy of Breastfeeding Medicine Protocol #6, Revision 2019. Breastfeed Med. 2020 Jan;15(1):5-16. doi: 10.1089/bfm.2019.29144.psb. Epub 2020 Jan 7. Erratum in: Breastfeed Med. 2021 Aug;16(8):662. PMID: 31898916.
97. Zimmerman D, et al.
ABM Clinical Protocol #37: Physiological Infant Care-Managing Nighttime
Breastfeeding in Young Infants.Breastfeed Med. 2023 Volume 18, Number 3.
DOI: 10.1089/bfm.2023.29236.abm
98. Galbally M, Lewis AJ, McEgan K, Scalzo K, Islam FA. Breastfeeding and infant sleep patterns: an Australian population study. J Paediatr Child Health. 2013 Feb;49(2): E147-52. doi: 10.1111/jpc.12089. Epub 2013 Jan 21. PMID: 23331519.
99. Brown, A., &
Harries, V. Infant sleep and night feeding patterns during later infancy:
association with breastfeeding frequency, daytime complementary food intake,
and infant weight. Breastfeed
Med. 2015 10(5), 246–252.
https://doi.org/10.1089/bfm.2014.0153
100. Postnatal care. London: National Institute for Health and Care Excellence (NICE); 2021 Apr 20. PMID: 34197057.
101. Moon RY; Task Force on Sudden Infant death Syndrome. SIDS and Other Sleep-Related Infant Deaths: Evidence Base for 2016 Updated Recommendations for a Safe Infant Sleeping Environment. Pediatrics. 2016 Nov;138(5):e20162940. doi:10.1542/peds.2016-2940. PMID: 27940805.
102. Czosnykowska-Łukacka
M, Królak-Olejnik B, Orczyk-Pawiłowicz M. Breast Milk Macronutrient Components
in Prolonged Lactation. Nutrients.
2018 Dec 3;10(12):1893.
doi: 10.3390/nu10121893. PMID: 30513944; PMCID: PMC6316538.
103. Czosnykowska-Łukacka
M, Orczyk-Pawiłowicz M, Broers B, Królak-Olejnik B. Lactoferrin in Human Milk
of Prolonged Lactation. Nutrients.
2019 Oct 2;11(10):2350.
doi: 10.3390/nu11102350. PMID: 31581741; PMCID: PMC6835443.
104. Ojantausta,
O., Pöyhönen, N., Ikonen, R., & Kaunonen, M. Health professionals'
competencies regarding breastfeeding beyond 12 months: a systematic review. Int Breastfeed J.
2023 18(1), 55.
https://doi.org/10.1186/s13006-023-00591-z
105. Cockerham-Colas,
L., Geer, L., Benker, K., & Joseph, M. A. Exploring and influencing the
knowledge and attitudes of health professionals towards extended breastfeeding.
Breastfeed
Med. 2012 7(3), 143–150.
https://doi.org/10.1089/bfm.2011.0027
106. Munblit, D., Verhasselt, V. Allergy prevention by breastfeeding: possible mechanisms and evidence from human cohorts. Curr Opin Allergy Clin Immunol. 2016. October, 16(5):p 427-433. DOI: 10.1097/ACI.0000000000000303
107. Toca, MC., Morais, MB., Vázquez-Frias, R., Becker-Cuevas, DJ., Boggio-Marzet, CG., Delgado-Carbajal, L., et al. Consenso sobre el diagnóstico y el tratamiento de la alergia a las proteínas de la leche de vaca de la Sociedad Latinoamericana de Gastroenterología, Hepatología y Nutrición. Rev Gastroenterol Méx. 2022. Volume 87, Issue 2, Pages 235-250, ISSN 0375-0906,https://doi.org/10.1016/j.rgmx.2022.03.007.
108. Vandenplas Y, Broekaert I, Domellöf M, Indrio F, Lapillonne A, Pienar C, et al. An ESPGHAN position paper on the diagnosis, management and prevention of cow's milk allergy. J Pediatr Gastroenterol Nutr. 2023 Jul 26. doi: 10.1097/MPG.0000000000003897. Epub ahead of print. PMID: 37491714.
109. Rajani, P.
S., Martin, H., Groetch, M., & Järvinen, K. M. Presentation and Management
of Food Allergy in Breastfed Infants and Risks of Maternal Elimination Diets.J
Allergy Clin Immunol Pract. 2020 8(1), 52–67.
https://doi.org/10.1016/j.jaip.2019.11.007
110. Urashima M, Mezawa H,
Okuyama M, Urashima T, Hirano D, Gocho N, et al. Primary Prevention of
Cow's Milk Sensitization and Food Allergy by Avoiding Supplementation With
Cow's Milk Formula at Birth: A Randomized Clinical Trial. JAMA Pediatr. 2019
Dec 1;173(12):1137-1145.
doi: 10.1001/jamapediatrics.2019.3544. PMID: 31633778; PMCID: PMC6806425.
111. Munblit D,
Perkin MR, Palmer DJ, Allen KJ, Boyle RJ. Assessment of Evidence About Common
Infant Symptoms and Cow's Milk Allergy. JAMA Pediatr. 2020 Jun 1;174(6):599-608.
doi: 10.1001/jamapediatrics.2020.0153. PMID: 32282040.
112. Keane, A., Lyons, F., Aebi-Popp, K., Feiterna-Sperling, C., Lyall, H., Martínez Hoffart, A., et al. Guidelines and practice of breastfeeding in women living with HIV-Results from the European INSURE survey. HIV medicine. 2024 25(3), 391–397. https://doi.org/10.1111/hiv.13583
113. Powell, A. M., Knott-Grasso, M. A., Anderson, J., Livingston, A., Rosenblum, N., Sturdivant, H., et al. Infant feeding for people living with HIV in high resource settings: a multi-disciplinary approach with best practices to maximize risk reduction. Lancet regional health. Americas. 2023 22, 100509. https://doi.org/10.1016/j.lana.2023.100509
114. Prestileo,
T., Adriana, S., Lorenza, D. M., & Argo, A. From Undetectable Equals
Untransmittable (U=U) to Breastfeeding: Is the Jump Short?.Infect Dis Rep.
2022 14(2), 220–227.
https://doi.org/10.3390/idr14020027
115. World
Health Organization.Guideline: updates on HIV and infant feeding: the duration
of breastfeeding, and support from health services to improve feeding practices
among mothers living with HIV. 2016
https://iris.who.int/bitstream/handle/10665/246260/9789241549707-eng.pdf?sequence=1
116. Ministerio de Salud y Protección Social. Fondo de Poblaciones de las Naciones Unidas - UNFPA. Guía de Práctica Clínica basada en la evidencia científica para la atención de la infección por VIH en niñas y niños menores de 13 años de edad. 2014. Colombia. Available from: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/PP/GPC-corta-VIH-pediatrica-final.pdf
117. Bamford A, Foster C, Lyall H. Infant feeding: emerging concepts to prevent HIV transmission. Curr Opin Infect Dis. 2024 Feb 1;37(1):8-16. doi: 10.1097/QCO.0000000000000986. Epub 2023 Oct 27. PMID: 37889586; PMCID: PMC10734781.
118. Abuogi L, Noble L, Smith C; COMMITTEE ON PEDIATRIC AND ADOLESCENT HIV; SECTION ON BREASTFEEDING. Infant Feeding for Persons Living with and at Risk for HIV in the United States: Clinical Report. Pediatrics. 2024 Jun 1;153(6):e2024066843. doi: 10.1542/peds.2024-066843. PMID: 38766700.
119. Panel on Treatment of HIV During Pregnancy and Prevention of Perinatal Transmission. Recommendations for the Use of Antiretroviral Drugs During Pregnancy and Interventions to Reduce Perinatal HIV Transmission in the United States. Department of Health and Human Services. 2024. Available at https://clinicalinfo.hiv.gov/en/guidelines/perinatal. Accessed oct 2024
120. Foong, S. C., Tan, M. L., Foong, W. C., Marasco, L. A., Ho, J. J., & Ong, J. H. Oral galactagogues (natural therapies or drugs) for increasing breast milk production in mothers of non-hospitalised term infants. Cochrane Database Syst Rev. 2020 5(5), CD011505. https://doi.org/10.1002/14651858.CD011505.pub2
121. Hussain, N. H. N., Noor, N. M., Ismail, S. B., Zainuddin, N. A., & Sulaiman, Z. Metoclopramide for Milk Production in Lactating Women: A Systematic Review and Meta-Analysis.Korean J Fam Med. 2021 42(6), 453–463. https://doi.org/10.4082/kjfm.20.0238
122. Grzeskowiak,
L. E., Wlodek, M. E., & Geddes, D. T. What Evidence Do We Have for
Pharmaceutical Galactagogues in the Treatment of Lactation Insufficiency? -A
Narrative Review. Nutrients.
2019 11(5), 974.
https://doi.org/10.3390/nu11050974
123. B.McBride, G. M., Stevenson, R., Zizzo, G., Rumbold, A. R., Amir, L. H., Keir, A.,et al . Women's experiences with using domperidone as a galactagogue to increase breast milk supply: an australian cross-sectional survey. Int Breastfeed J. 2023 18(1), 11. https://doi.org/10.1186/s13006-023-00541-9
124. Umur N, et al.Investigation of the effect of metoclopramide on proliferation signal molecules in breast tissue. Int J Exp Pathol. 2022 PMID: 35243705
125. Van
Amesfoort, J. E., Van Mello, N. M., & van Genugten, R. Lactation induction
in a transgender woman: case report and recommendations for clinical practice. Int Breastfeed J.
2024 19(1), 18.
https://doi.org/10.1186/s13006-024-00624-1
126. Asztalos, E. V., & Kiss, A. Early Breast Milk Volumes and Response to Galactogogue Treatment. Children (Basel, Switzerland). 2022 9(7), 1042. https://doi.org/10.3390/children9071042
127. Yuen, M,
Hall, OJ, Masters, GA, Nephew, BC, Carr, C, Leung, K, et al. The Effects of
Breastfeeding on Maternal Mental Health: A Systematic Review.J Womens Health. 2022 31(6), 787–807.
https://doi.org/10.1089/jwh.2021.0504
128. Castañón SC, & Pinto LJ.Mejorando la pesquisa de depresión posparto a través de un instrumento de tamizaje, la escala de depresión posparto de Edimburgo [Use of the Edinburgh Postnatal Depression Scale to detect postpartum depression].Rev Med Chil. 2008 136(7), 851–858.
129. Días, CC, & Figueiredo, B. Breastfeeding and depression: a systematic review of the literature. J Affect Disord. 2015 171, 142–154. https://doi.org/10.1016/j.jad.2014.09.022.
130. Chowdhury R, Sinha B, Sankar MJ, Taneja S, Bhandari N, Rollins N, et al. Breastfeeding and maternal health outcomes: a systematic review and meta-analysis. Acta Paediatr 2015; 104(Suppl. 467): 96–113.
131. McGuire, E, Murray, S, & Duffy, RM. Pregnancy and breastfeeding in mental health policy: a narrative review.Ir J Psychol Med. 2023 40(4), 592–600. https://doi.org/10.1017/ipm.2023.32
![]()